“新冠康复了,但我的记忆力仿佛被削弱了一半,有时甚至连刚刚要说什么都忘记。”——你是否也有过这样的经历?
许多“长新冠”患者在感染新冠病毒数月甚至数年后,依然饱受“脑雾”、情绪波动、注意力难以集中等问题的困扰。
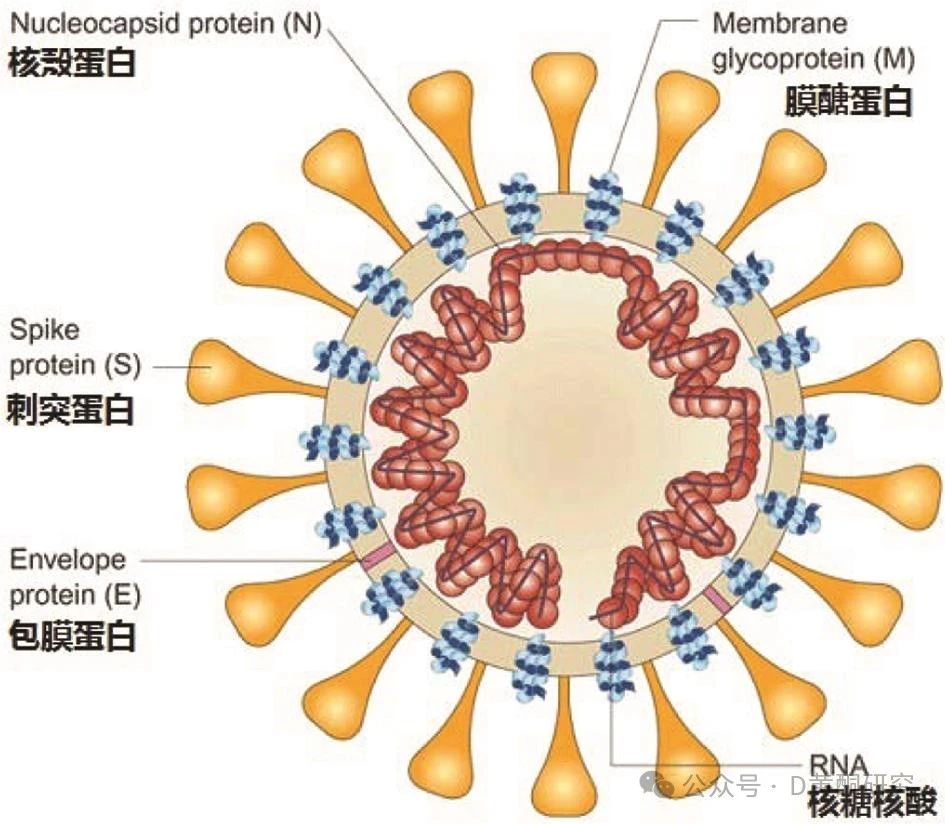
而最新研究揭示,这背后的“罪魁祸首”很可能是一种新冠病毒的关键成分——刺突蛋白。
2024年12月11日,德国、丹麦等多家机构的科学家在Cell子刊期刊《宿主与微生物》上发表了一项重磅研究(2024年12月11日)。
研究发现,尽管新冠病毒在人体内已经被清除,但其刺突蛋白却可滞留在“颅骨-脑膜连接”这一关键部位长达4年,并可能通过“通道”进入大脑,引发慢性神经炎症,导致认知功能障碍等“长新冠”症状。
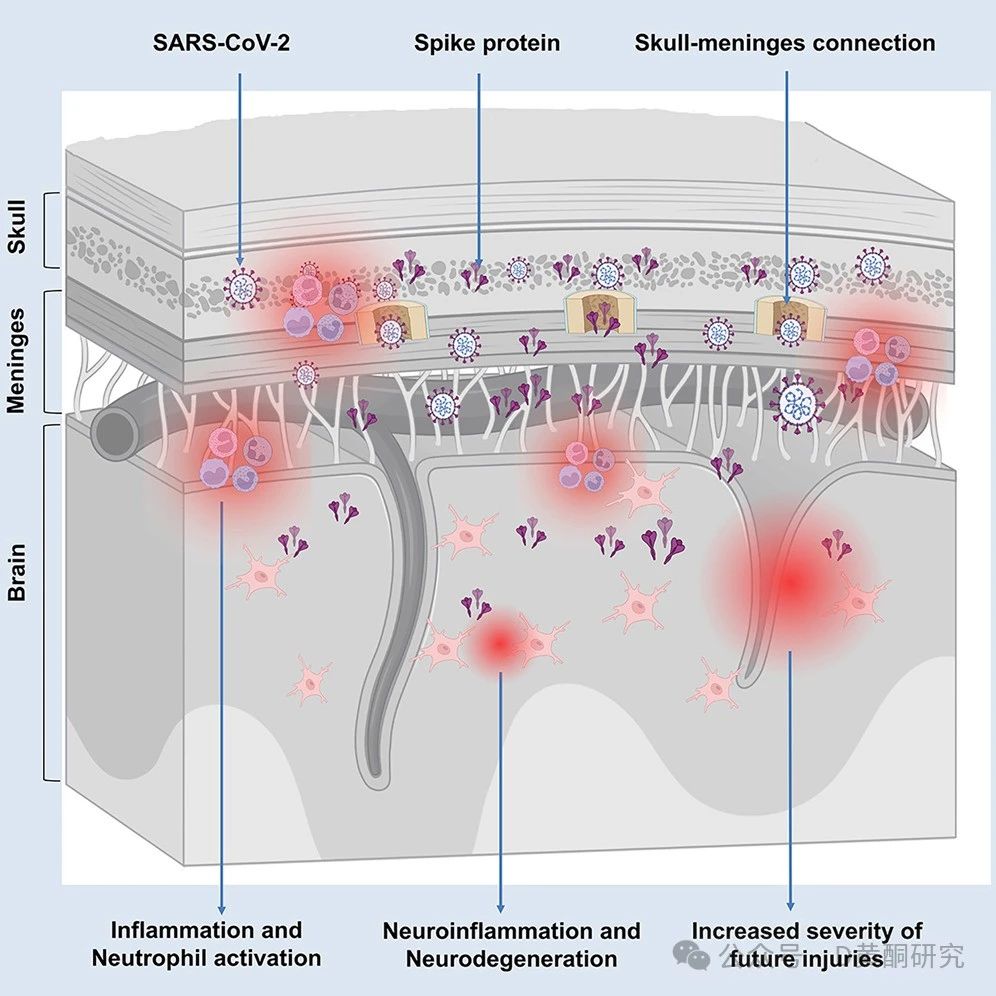
颅骨和大脑之间的秘密通道:病毒残骸的“潜伏地”
要理解刺突蛋白为何会对大脑造成如此深远的影响,我们首先要了解“颅骨-脑膜连接”——这是外周免疫系统与中枢神经系统交汇的重要区域,可以想象成大脑的“护城河”。
通常情况下,这道屏障能够有效抵御外来入侵者,保护大脑不受损伤。
然而,新冠病毒的刺突蛋白却善于“潜伏”在颅骨骨髓和脑膜附近,悄悄触碰这条“护城河”。
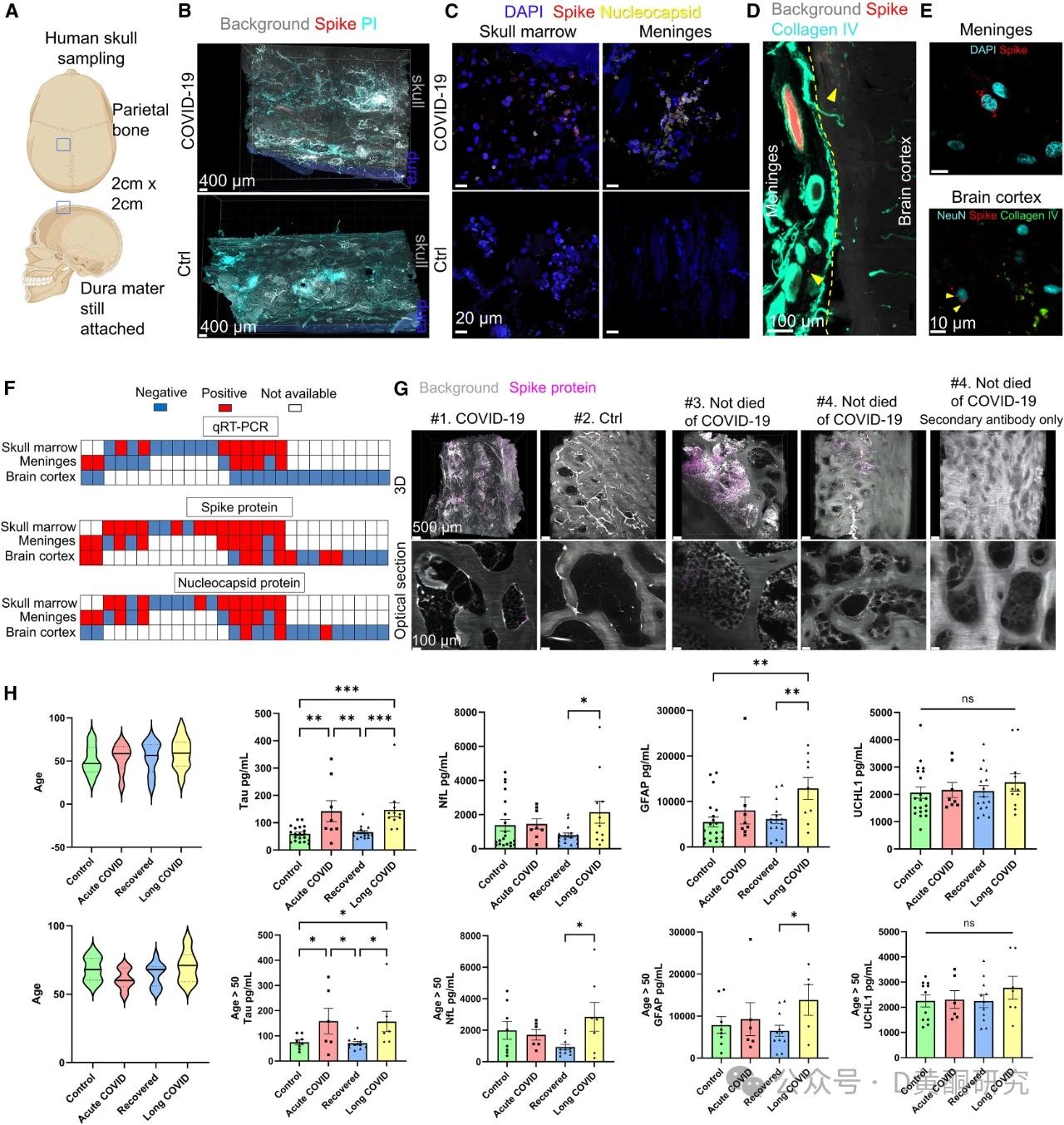
研究团队通过光学组织透明化技术,将新冠死亡患者的颅骨和脑组织进行深入扫描,结果发现,在感染消退后,约45%的刺突蛋白残留在血管之外,27%的刺突蛋白与免疫细胞共定位,显示出这些蛋白已渗透至脑膜和大脑组织。
TLR4受体:“警报器”被触发后的连锁反应
刺突蛋白为何会引发如此严重的神经损伤?答案在于它的“恶意结合”能力。研究表明,刺突蛋白可以与TLR4受体结合——这是免疫系统的“警报器”,一旦被触发,就会引发一系列强烈的免疫反应。
这种结合会激活中性粒细胞胞外陷阱。中性粒细胞胞外陷阱就像一张“巨大的蜘蛛网”,用来捕捉病毒残骸。然而,当这张“网”失控时,就会黏住并杀伤身体自己的神经细胞,导致神经组织损伤。
研究发现,这种免疫反应过度会导致神经细胞受到氧化压力、损伤甚至死亡,而这正是导致“脑雾”和情绪障碍的主要原因。
“沉默杀手”:刺突蛋白如何引发脑损伤
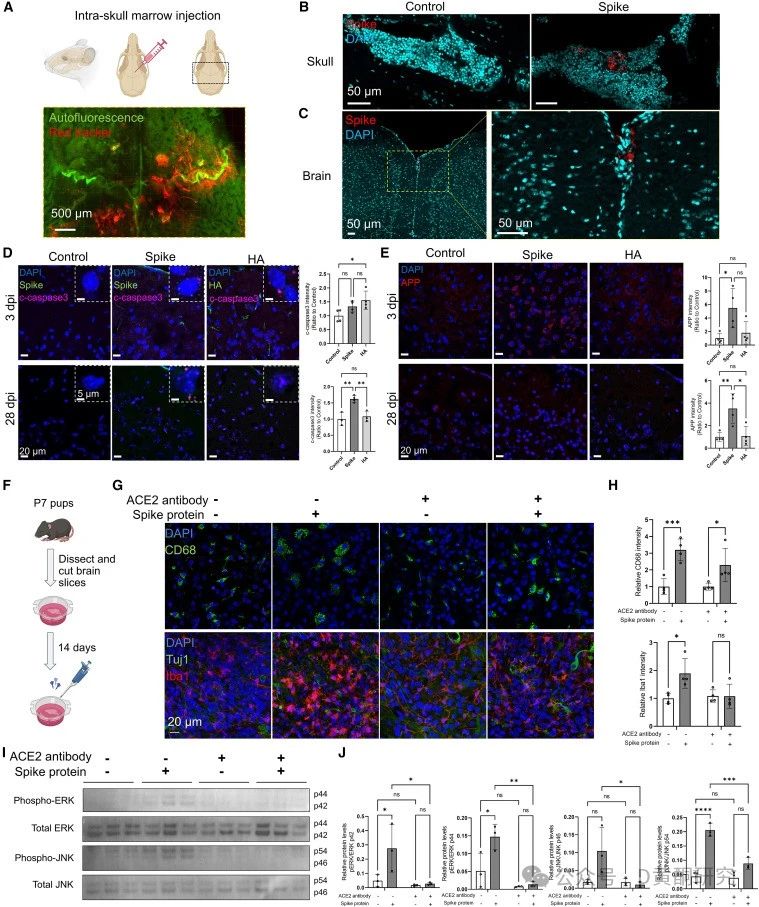
在小鼠实验中,科学家通过将刺突蛋白注射入颅骨骨髓,发现其短时间内便扩散至脑膜和大脑皮层,诱发了显著的神经炎症反应。
研究显示,这种炎症通过激活MAPK-JNK信号通路,引发了神经元应激反应,增加了Tau蛋白和神经丝轻链(NfL)等神经退行性疾病标志物的水平。
在健康的大脑中,tau蛋白就像“轨道维护工”,负责稳定神经元内的微管结构,帮助养分和信号顺畅传递。但如果tau蛋白出现异常,比如过度磷酸化,就会“脱轨”聚集成团,形成“神经纤维缠结”,导致神经元结构崩塌,最终引发记忆力下降、脑雾等症状。tau蛋白异常升高,是阿尔茨海默病等神经退行性疾病的典型特征。
NfL(神经丝轻链)是神经元“支架”——神经纤维的重要组成部分。正常情况下,这种蛋白只存在于神经元内部,不会出现在血液或脑脊液中。但当神经元受到损伤时,NfL就会“泄漏”出来,进入脑脊液甚至血液。因此,NfL水平升高就像“破裂水管流出的水”,预示神经元纤维正在遭受损害。NfL的升高常被用作检测脑卒中、创伤性脑损伤、帕金森病等神经系统疾病的“报警信号”。
这些变化不仅使小鼠表现出焦虑样行为,还加重了其在脑卒中和创伤性脑损伤模型中的神经损伤,进一步证明刺突蛋白会让大脑更易受到外部损伤。
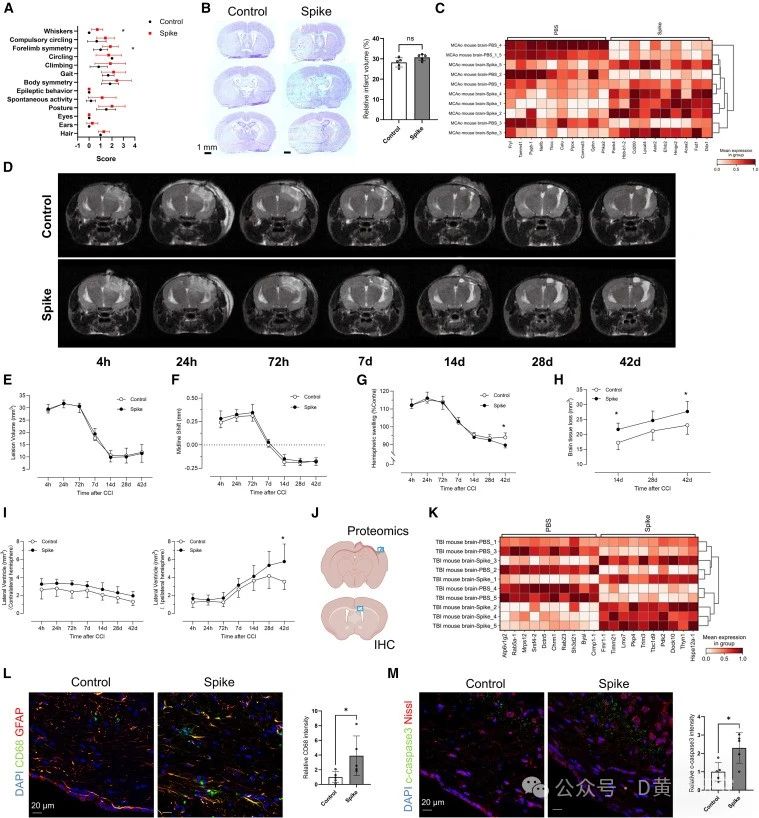
mRNA疫苗的保护作用:减轻但无法完全消除
令人欣慰的是,研究还发现,接种辉瑞/BioNTech mRNA疫苗的小鼠在感染奥密克戎毒株后,其大脑中的刺突蛋白水平显著降低。疫苗虽然无法完全清除刺突蛋白,但显著减少了其在颅骨-脑膜连接处的积累,从而减轻了神经炎症。
这提示我们,mRNA疫苗接种不仅有助于降低感染风险,还在一定程度上保护了大脑免受病毒蛋白的侵害。
然而,这一保护机制并非万能,因此,如何在感染后清除刺突蛋白,仍是科学家亟待解决的难题。
“脑雾”不是心理问题,而是生理损伤
这项研究揭示,“长新冠”患者的神经系统后遗症并非单纯的心理问题,而是存在可被检测到的生理变化。脑脊液中Tau蛋白和神经丝轻链水平的上升,表明刺突蛋白的长期残留与神经退行性疾病存在关联。
简单来说,刺突蛋白就像“顽固的客人”,虽然主病毒早已被清除,但其残留成分仍在体内“捣乱”,不断引发免疫系统的“误伤”。这也解释了为什么许多“长新冠”患者会出现认知功能下降、睡眠障碍等症状。
未来的希望:针对刺突蛋白的新型疗法
研究提示我们,要有效应对“长新冠”带来的神经系统后遗症,需要研发针对刺突蛋白的清除和抑制方案。科学家们正在探索如何通过药物或免疫调节手段,帮助身体更快地清除这些“残骸”,减轻长期炎症和神经损伤。
同时,通过检测脑脊液或血浆中相关蛋白水平,可以为“长新冠”患者提供早期筛查和干预方案。这意味着,未来我们有望通过简单的生物标志物检测,预测哪些患者可能发展为神经退行性疾病,从而及时采取防护措施。(全文完)
当大脑遭受炎症刺激时,TLR4受体(类似“警报开关”)会被激活,触发强烈的免疫反应,释放出大量炎症因子。这种过度反应,就像“火警误报”引来一群消防员,却让原本健康的神经元“无辜受损”。
长期如此,大脑内的tau蛋白逐渐失控,从正常的“轨道维护工”变成“捣乱分子”,相互缠结形成毒性斑块,阻塞神经元信号通路,最终导致记忆力减退、思维迟缓,甚至引发阿尔茨海默病等神经退行性疾病。
而植物多酚DHM正是“灭火英雄”,针对这场“免疫风暴”提供精准解决方案。研究表明,DHM能够抑制TLR4表达,就像给“警报开关”装上智能调控系统,避免免疫系统误伤神经元。
此外,DHM通过其强大的抗氧化和抗炎特性,能够中和自由基,减轻神经元压力,从根源上减少tau蛋白的异常磷酸化,防止它们缠结成毒性纤维团。更重要的是,DHM还能促进自噬机制的激活,就像大脑的“清道夫”,帮助清理已形成的tau蛋白缠结,让神经细胞恢复活力。
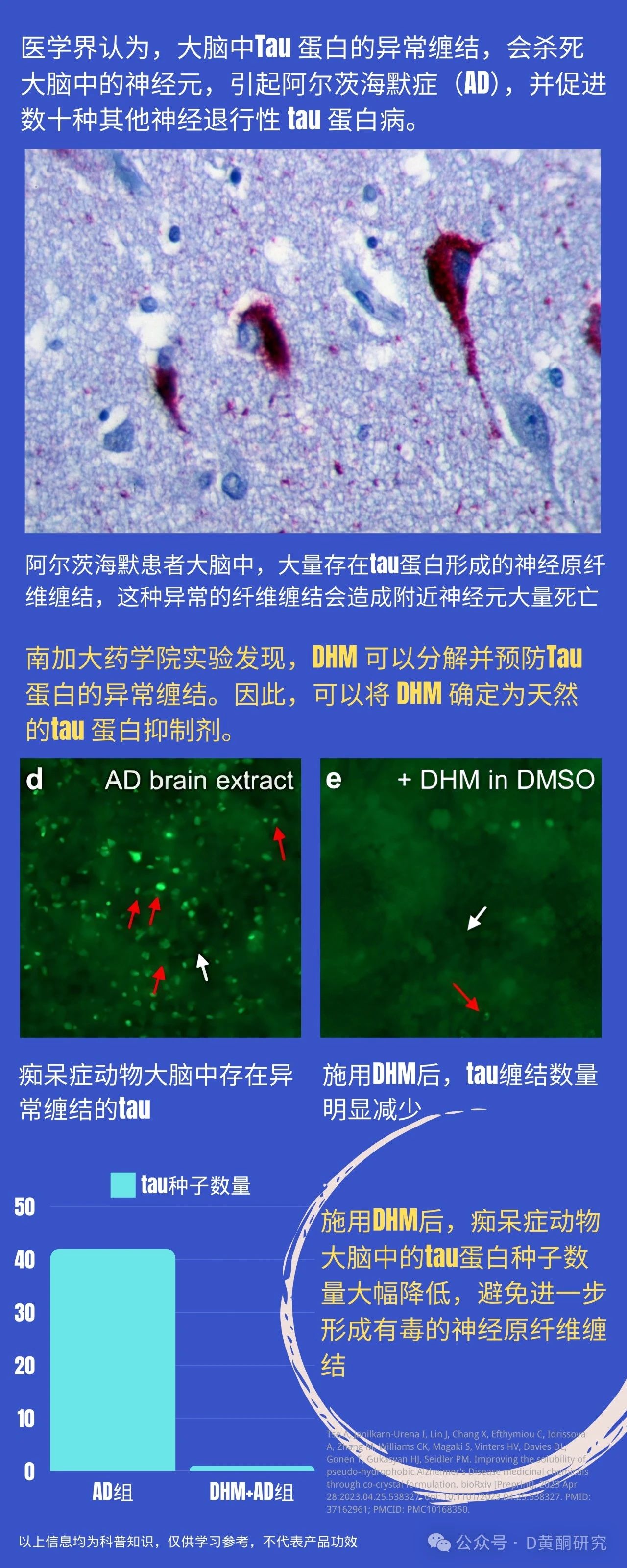
针对主观认知下降(SCD)受试者的数据显示,血液tau蛋白标志物减少40%以上,同时认知功能显著提升。

这意味着,DHM不仅是“预防者”,更是“修复者”,能够有效保护大脑免受慢性炎症和毒性蛋白的侵害,提升记忆力和专注力,让你远离“脑雾”和衰老带来的记忆衰退。
选择DHM,就相当于为大脑按下“保护重启键”,让神经元保持年轻状态,免受毒性蛋白的困扰。聪明之选,从呵护大脑开始!
联系人:吴晨雪
手机:15602945134
电话:0755-32960208
邮箱:rosellebio@126.com
地址: 广东省深圳市盐田区壹海中心1203室