阿尔茨海默病(AD)是最主要的神经退行性疾病,其复杂的发病机制一直是医学研究的重点难点。基于中枢神经系统中淀粉样蛋白的疾病机制假说虽然在学界占据主流,但由此开发的药物在临床上获益较差,因此,多因素假说开始受到普遍的重视。
近日,来自意大利纳米技术研究所的团队在《科学》子刊《科学·发现》上发表一篇题为“Investigating gut alterations in Alzheimer’s disease: In-depth analysis with micro- and nano-3D X-ray phase contrast tomography(研究阿尔茨海默病的肠道改变:利用微米和纳米三维 X 射线相衬断层扫描进行深入分析)”,阐明了其通过先进的检测技术发现阿尔茨海默病发展早期的独特肠道病理变化,为AD的疾病早期干预提供了重要依据。

创新研究方法
这项研究采用了前沿的XPCT成像技术。与传统组织学方法相比,XPCT具有三大独特优势:首先,它实现了真正的三维无损成像,无需对样本进行切片或染色处理,完整保留了组织结构的空间信息;其次,其分辨率可达80纳米,比常规光学显微镜高出近一个数量级,能够清晰识别单个细胞的亚结构;最后,该技术基于X射线的相位对比原理,对软组织成像具有极高的灵敏度。
研究团队分别在法国SOLEIL同步辐射装置的ANATOMIX光束线和欧洲同步辐射装置(ESRF)的ID16A、ID19光束线上完成了实验。通过调节X射线能量、样品-探测器距离等参数,研究人员实现了从微米级(0.65-3.07μm)到纳米级(80nm)的多尺度成像。特别是纳米级XPCT技术,首次在阿尔茨海默病研究中实现了对端粒细胞这类特殊间质细胞的三维可视化,这在传统电子显微镜下都难以实现。
在样本选择上,研究采用了三种具有代表性的阿尔茨海默病小鼠模型:APP/PS1和APP23两种携带人类基因突变的家族性阿尔茨海默病模型,以及模拟散发性阿尔茨海默病的SAMP8加速衰老模型。
肠道结构的特异性改变
通过XPCT技术,研究人员在阿尔茨海默病模型小鼠的回肠部位观察到了一系列显著的结构改变。最引人注目的是肠道绒毛的异常伸长现象。在APP/PS1和APP23这两种家族性阿尔茨海默病模型中,绒毛长度比同龄健康对照组增加了约30%,这一变化具有高度统计学意义(p<0.0001)。绒毛作为肠道吸收营养的关键结构,其形态改变可能直接影响营养物质的吸收效率。
与此同时,研究还发现肠隐窝深度明显增加。隐窝是肠道干细胞所在的"增殖中心",其深度变化反映了干细胞增殖和分化的异常。定量分析显示,阿尔茨海默病小鼠的隐窝深度比对照组增加了25-40%(p<0.001)。这一发现提示阿尔茨海默病可能影响肠道上皮的更新机制。
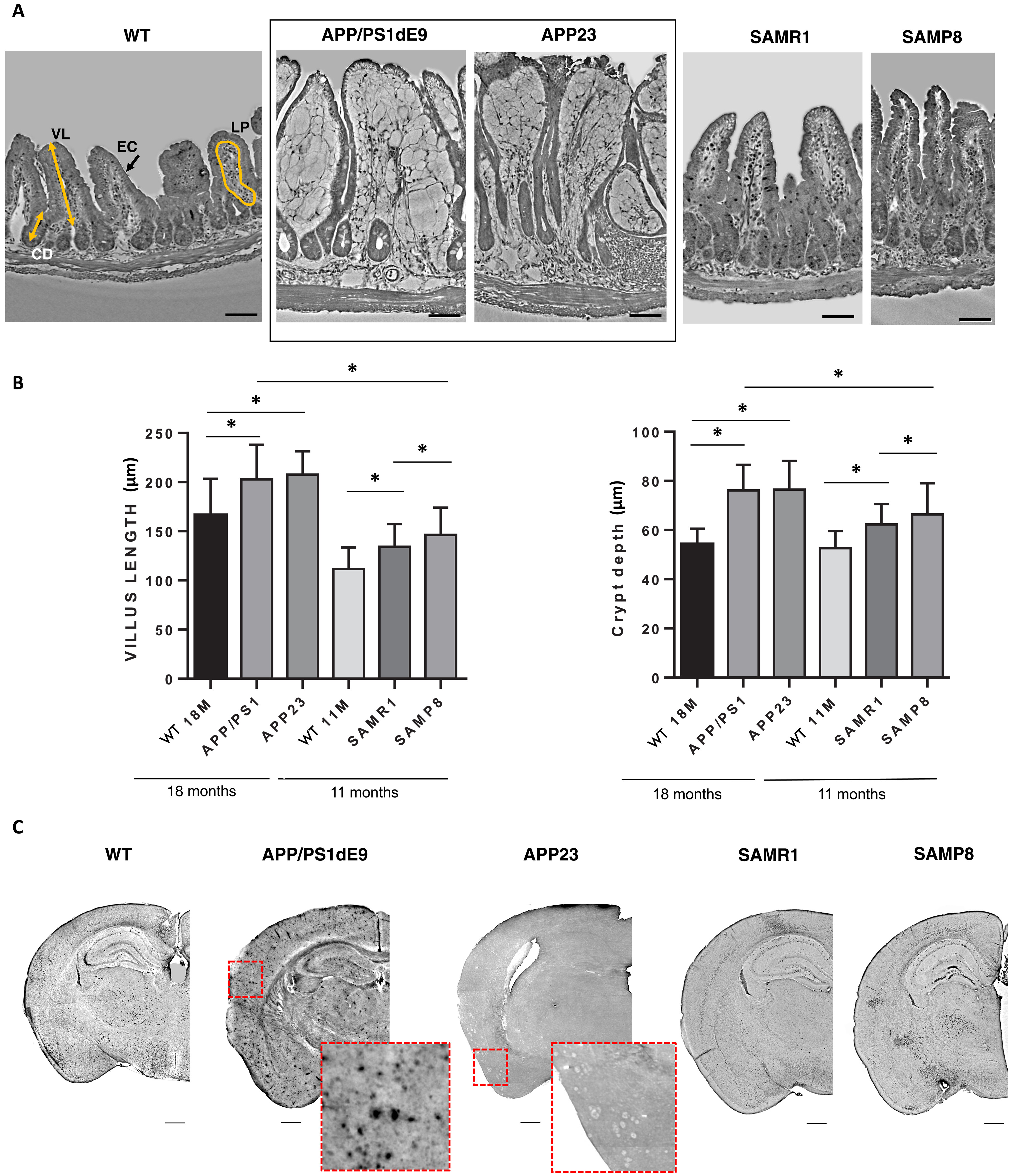
XPCT 揭示了 AD 突变小鼠的肠绒毛和隐窝变化。( A ) 不同痴呆模型及其对照组的回肠形态的 XPCT 图像。白色像素代表低密度组织,而深色像素代表高密度组织。( B ) 不同小鼠模型中绒毛长度(左侧)和隐窝深度(右侧)的量化。( C ) 小鼠模型半脑的 XPCT。
更值得关注的是肠道屏障完整性的破坏。XPCT成像清晰显示,阿尔茨海默病小鼠的上皮层厚度减少了近50%,同时固有层的密度显著降低。这些结构变化可能导致肠道通透性增加,即所谓的"肠漏"现象。这一发现为理解阿尔茨海默病中观察到的系统性炎症提供了结构基础。
研究还发现,这些肠道结构改变在不同模型中表现出明显的差异。家族性阿尔茨海默病模型(APP/PS1和APP23)的结构异常更为显著,而散发性模型(SAMP8)的变化相对轻微。这种差异提示遗传因素可能在肠道改变中扮演重要角色,也为理解不同类型阿尔茨海默病的发病机制提供了新线索。
细胞水平的重大发现
在纳米级分辨率下,研究取得了多项突破性的细胞水平发现。最主要的是首次在阿尔茨海默病模型中清晰观察到端粒细胞的形态变化。这类具有长突起的特殊间质细胞在组织修复中起关键作用,其独特的"胞体-端粒"结构通过XPCT三维重建得到了完美呈现。定量分析显示,阿尔茨海默病模型中的端粒细胞数量比对照组减少了约35%,这可能严重影响肠道的自我修复能力。
研究还详细分析了两种重要的肠道上皮细胞——杯状细胞和潘氏细胞的改变。杯状细胞负责分泌保护肠道的黏液,在阿尔茨海默病模型中,这些细胞的黏液分泌量明显减少。通过XPCT技术,研究人员甚至可以直接观察到黏液分泌颗粒的分布异常。潘氏细胞作为肠道免疫防御的第一道防线,其抗菌颗粒的释放也出现紊乱。这些变化可能共同导致肠道微生物平衡的破坏和慢性炎症状态的维持。
特别值得关注的是肠道神经系统的改变。XPCT成像清晰地显示了肠肌间神经丛(Auerbach丛)和黏膜下神经丛(Meissner丛)中神经元的形态变化。这些神经元控制着肠道的蠕动和分泌功能,其异常可能直接影响肠道向大脑传递的信号。研究人员还观察到肠道血管系统中的红细胞分布异常,提示微循环可能受到影响。
在免疫系统方面,研究发现派尔集合淋巴结和孤立淋巴滤泡等肠道相关淋巴组织出现明显的结构重组。淋巴细胞聚集增加,生发中心扩大,这些变化都指向持续的免疫激活状态。这些发现为理解阿尔茨海默病中的系统性炎症提供了新的视角。
这项研究的发现具有深远的临床意义。从诊断角度看,肠道结构的改变可能早于典型的脑部症状出现,使其成为潜在的早期诊断标志物。与脑部影像学检查相比,肠道检查具有成本低、侵入性小的优势。研究人员特别指出,端粒细胞的数量变化和潘氏细胞的功能异常可能是最有前景的生物标志物候选。
在治疗方面,这些发现为开发新型干预策略提供了方向。相较于血脑屏障保护下的大脑,肠道更易成为治疗干预的靶点。基于研究结果,至少三种干预途径值得探索:修复肠道屏障完整性的药物、调节肠道菌群的益生菌疗法,以及针对特定肠道细胞类型的靶向治疗。特别是端粒细胞移植可能成为恢复肠道稳态的新方法。
研究基于“脑肠轴”理论提出的"肠漏-炎症-神经退行"假说为阿尔茨海默病的发病机制和干预提供了重要见解。根据这一假说,肠道屏障破坏导致细菌产物和炎症因子进入血液循环,引发系统性炎症,最终突破血脑屏障影响大脑功能。总之,该研究为早期发现阿尔茨海默病的新方法以及靶向脑肠轴的干预疗法提供了重要依据。
参考文献:
·Palermo F, Marrocco N, Dacomo L, et al. Investigating gut alterations in Alzheimer’s disease: In-depth analysis with micro-and nano-3D X-ray phase contrast tomography[J]. Science Advances, 2025, 11(5): eadr8511.
联系人:吴晨雪
手机:15602945134
电话:0755-32960208
邮箱:rosellebio@126.com
地址: 广东省深圳市盐田区壹海中心1203室