文献学习

标题:Feeding gut microbes to nourish the brain: unravelling the diet–microbiota–gut–brain axis.
期刊:Nature Metabolism
DOI:10.1038/s42255-024-01108-6
背景介绍
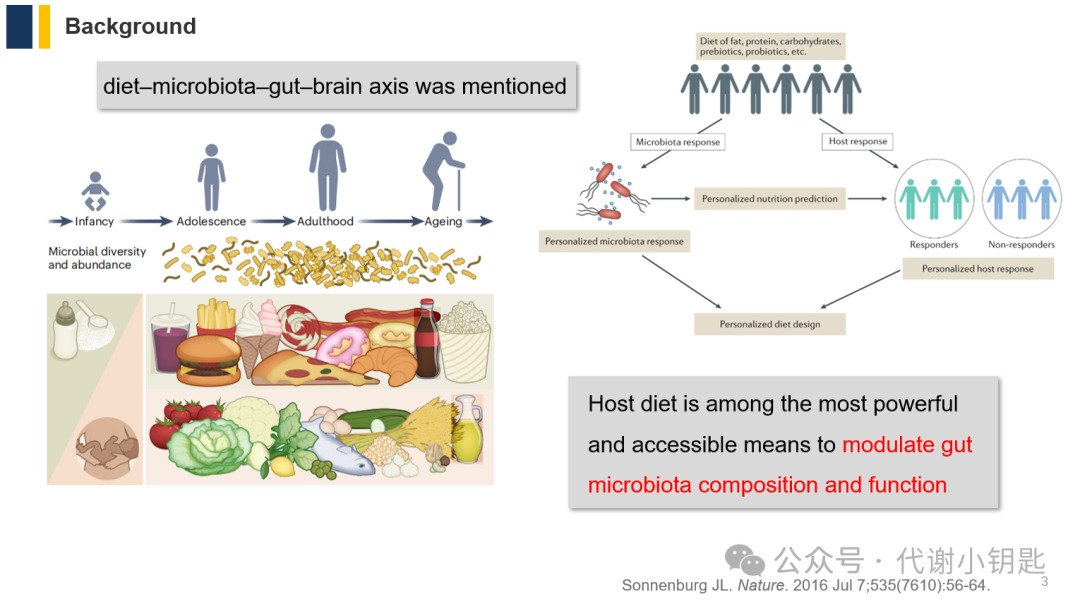
大脑疾病,包括与压力相关的精神障碍和认知功能障碍,患病率不断上升,不良的饮食习惯会加速疾病的发展。饮食是调节肠道菌群组成和功能的重要因素,健康的饮食摄入会有利于情绪和认知。近年来,肠道微生物以肠-脑轴通信作为调节大脑健康的潜在可控靶点,受到广泛关注。因此,作者提出通过饮食-微生物-肠-脑轴促进健康这样的设想。
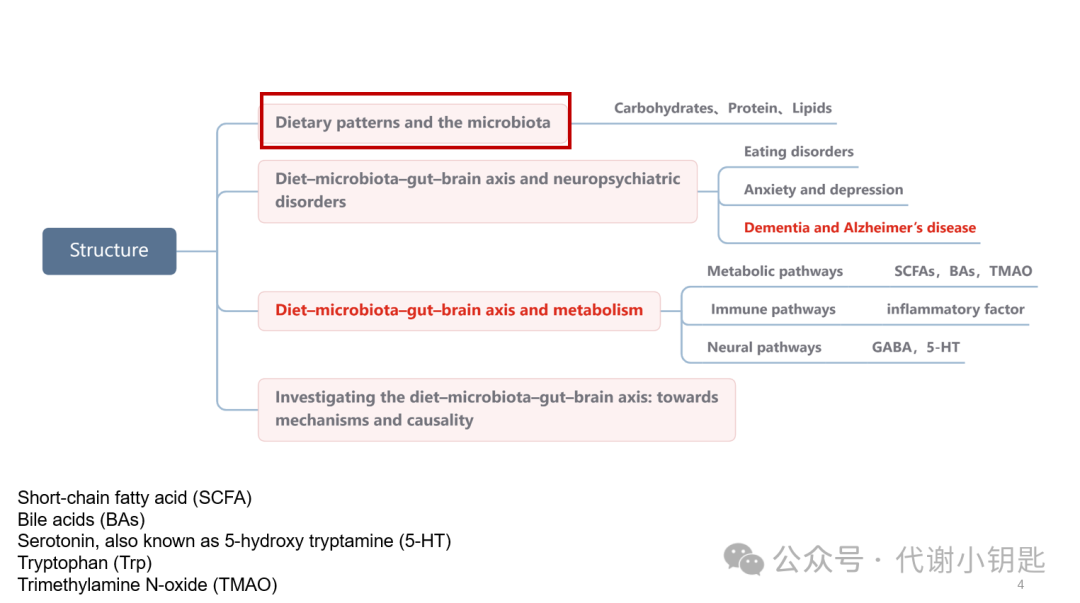
整篇文章的结构如下,第一部分作者阐述不同的饮食模式对肠道菌群的影响,后续包括单一成分的影响;第二部分论述饮食-微生物群-肠-脑轴和神经精神疾病的关系;第三部分,作者说明了肠道菌群和大脑产生交流的几种途径,包括通过代谢物、免疫通路、神经通路等,最后对于饮食-微生物群-肠-脑轴这个方向的研究方法进行了总结。
研究结果

首先介绍一些比较有特点的饮食模式。地中海饮食(Mediterraneandiet,MD)是一种以蔬菜水果、鱼类、五谷杂粮、豆类和橄榄油为主的饮食风格,强调简单、清淡且富含营养,有利于健康。主要源自希腊、西班牙、法国和意大利南部等处于地中海沿岸的南欧国家。西方饮食(Westerndiet, WD)的特点是高饱和脂肪和精制碳水化合物的消耗,伴随着高卡路里,高脂高糖的摄入,这种不均衡的饮食会带来许多健康风险。

生酮饮食(ketogenic-diet,KD),通常是指碳水化合物含量非常低、蛋白质含量适中、脂肪含量高的饮食。它模拟了人体饥饿的状态。脂肪代谢产生的酮体作为另一种身体能量的供给源可以产生对脑部的抗惊厥作用。炎症饮食模式,是一种利用基线炎症饮食指数(Inflammatory diet index,IDI)和经验饮食炎症模式(Empirical dietary inflammatory pattern,EDIP)与食物进行加权和计算而分类成的低、中、高炎症饮食,低炎症饮食被认为能降低多重急慢性疾病的发病风险。全谷物饮食由于高膳食纤维、低脂肪、低饱和脂肪酸、低胆固醇和低热量,具有一定的健康价值。
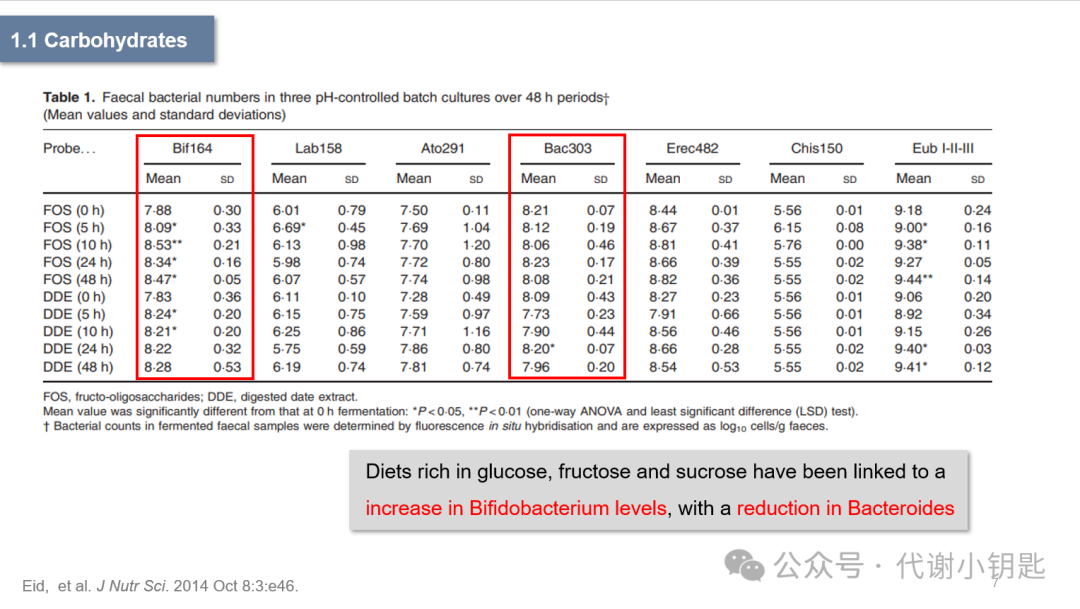
接下来介绍单一成分对肠道菌群的影响。碳水化合物占人类饮食中的很大一部分。碳水化合物会被酶分解为淀粉、葡萄糖、果糖、蔗糖和乳糖等。主食碳水化合物摄入量的改变可以在短短一周内迅速影响肠道微生物群的组成,富含葡萄糖、果糖和蔗糖的饮食与双歧杆菌水平的大幅增加有关,同时拟杆菌水平的显著减少。实际上,许多益生元由未消化的碳水化合物组成,通过促进益生菌的生长,对胃肠道产生积极的影响。

蛋白质是一种重要的膳食成分,是氨基酸的主要来源,对神经递质的合成和大脑健康至关重要。事实上,饮食中的蛋白质是我们无法合成的必需氨基酸的唯一来源(异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸、色氨酸和缬氨酸)。蛋白质与微生物多样性息息相关,“动物性饮食”,由肉类、鸡蛋和奶酪组成,该饮食的摄入可以提高肠道菌群β-多样性。“植物性饮食”,富含谷物、豆类、水果和蔬菜,其摄入可以提高短链脂肪酸(Short-chainfatty acids, SCFAs)的水平。
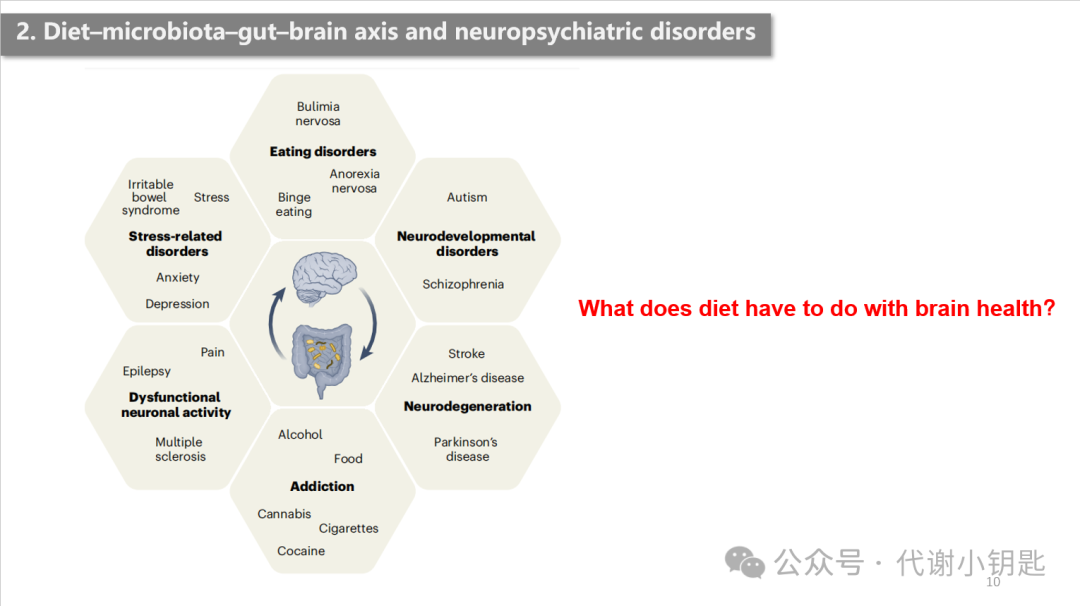
接着,第二部分,作者介绍了饮食-微生物群-肠-脑轴和神经精神疾病的联系。那么,饮食和大脑健康究竟有什么关系呢?下面举几个例子
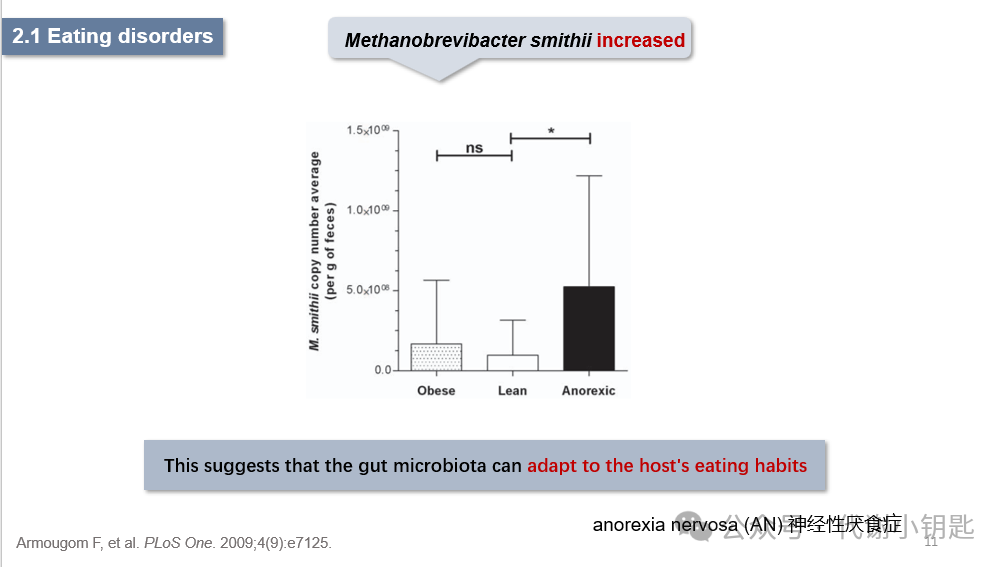
饮食失调,其中神经性厌食症(AN)与肠脑轴的关系被密切研究,在 AN 个体中观察到甲烷短杆菌的水平的升高,有报道称M. smithii 这是一种负责从食物中获取能量的细菌,它产生的甲烷能够有效分解摄入的食物,并将其转化为卡路里,供身体吸收并作为能量使用。这类似于一种肠道菌群补偿机制,在低热量饮食摄入的情况下尽可能获能,这说明肠道微生物群能适应宿主的饮食习惯。
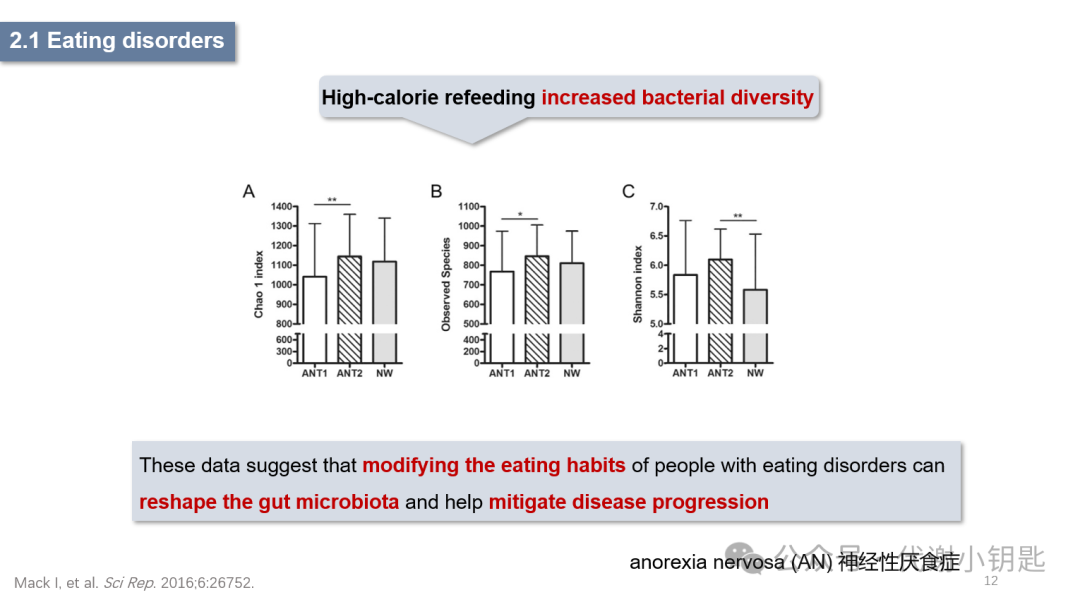
饮食失调,其中神经性厌食症(anorexia nervosa ,AN)与肠脑轴的关系被密切研究。有研究证明了对于AN患者,高热量再喂养干预会增加了肠道菌的多样性。这些数据表明,通过对于饮食失调的人群,调整其饮食习惯能够重塑肠道微生物群,利于疾病进展的缓解。
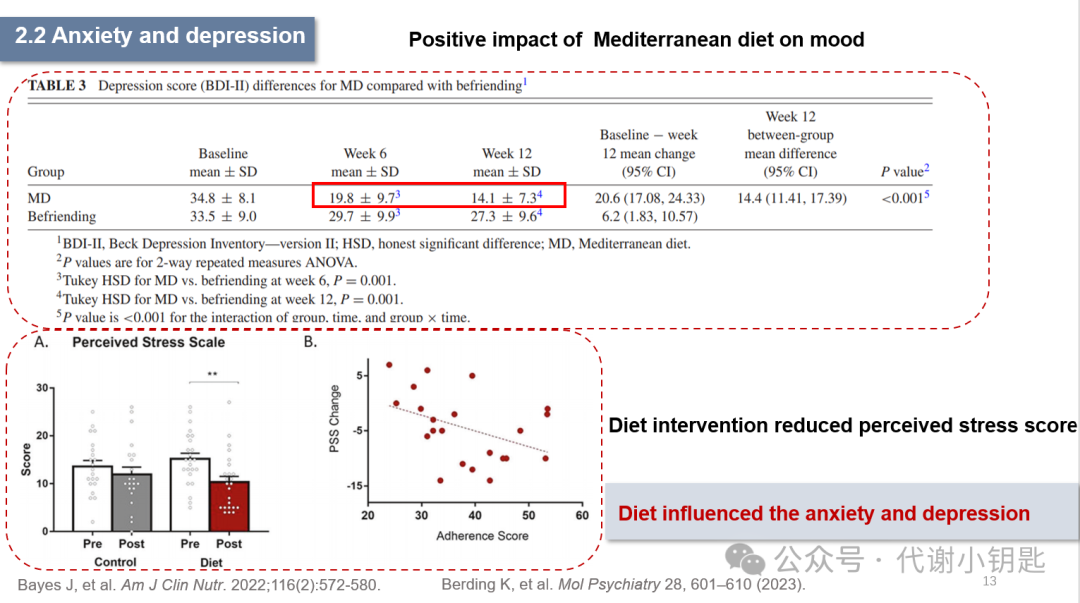
饮食受情绪的调控,焦虑和抑郁往往导致情绪化饮食,比如高糖高脂的摄入,对肠道微生物群产生有害影响。有研究强调了地中海饮食对情绪的积极影响(有利于治疗抑郁),在研究结束时,100% (n = 36)的地中海饮食组参与者的症状得到改善。此外,发酵食品和益生元的组合饮食改善了健康成年人的压力感知。
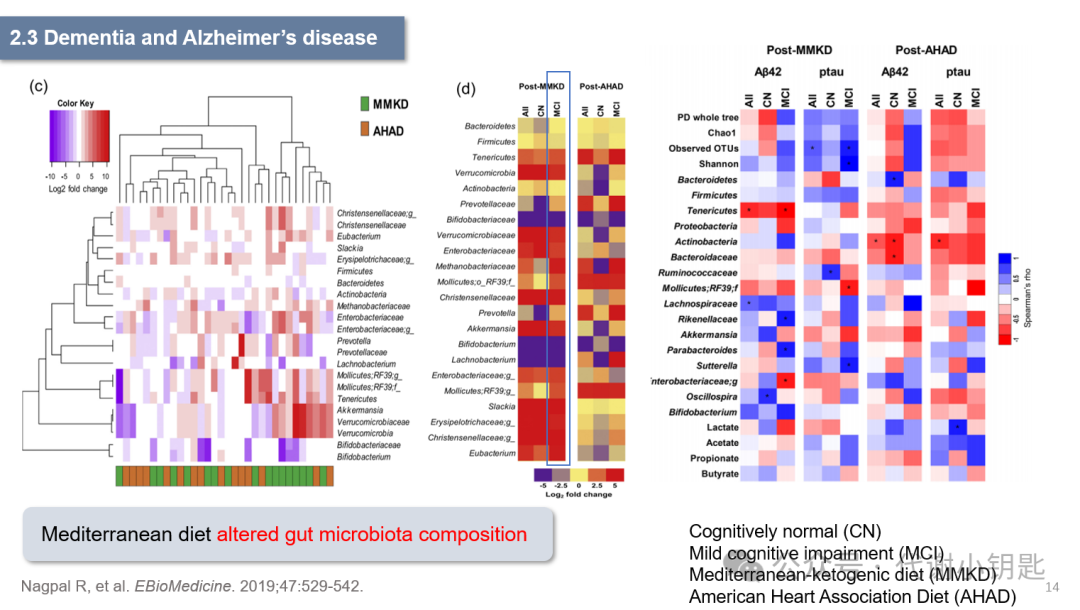
地中海饮食已被证明可以延缓阿尔兹海默症(Alzheimer’s disease,AD)的发作。有研究显示,不同的饮食模式会造就不同的肠道菌群分布,美国心脏协会饮食(American Heart Association Diet ,AHAD)和改良地中海生酮饮食(Modified Mediterranean-ketogenic diet ,MMKD)条件下的人类肠道菌群就存在着差异 (图c)。此外,坚持MMKD改变了肠道微生物群组成,软壁菌门、疣微菌门的增加、双歧杆菌和毛螺菌的减少,此外,这种饮食的调整还改变了肠道菌群的多样性(图d)。这与AD生物标志物如β-淀粉样蛋白(Aβ42)和 tau-p181 相关。
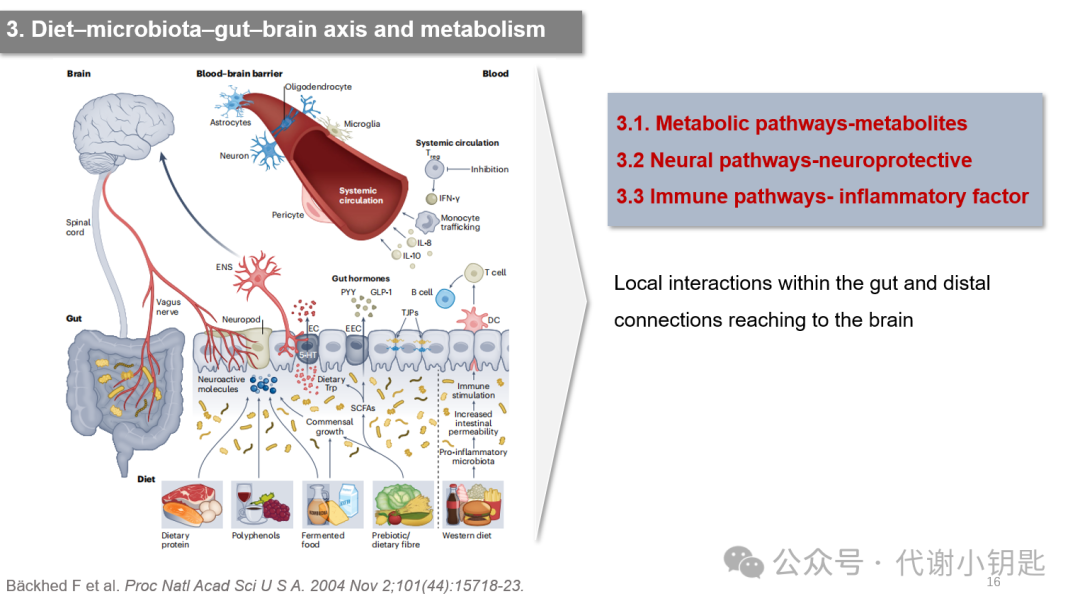
下面是第三部分,作者介绍了肠脑轴进行信息传递的几种途径。肠脑轴有三个常见的双向调节通路,分别是代谢途径、神经途径、免疫途径。首先,健康的饮食模式,富含纤维、水果和蔬菜,促进肠道微生物的多样性和有益代谢物的产生,如短链脂肪酸,这些代谢物可以通过血液直接进入大脑,增强认知和情绪处理。此外,在免疫途径,健康的饮食能促进肠道屏障的完整性,防止有害物质进入血液,并调节免疫系统,促进抗炎反应,有利于大脑功能。神经通路,肠道菌群会分泌一些神经递质,通过迷走神经传递信号,也在肠道微生物群向大脑传递信号中发挥着关键作用。接下来就从以上这三条途径进行介绍。
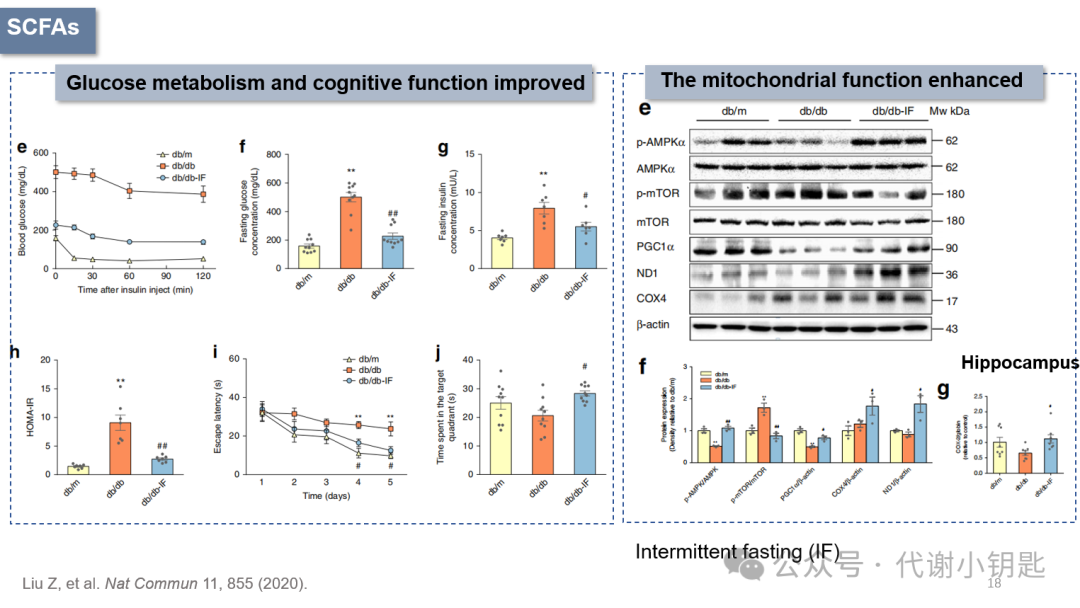
肠道菌群代谢物,特别是SCFAs(主要是乙酸盐、丙酸盐和丁酸盐)占肠道菌群代谢物的95%以上。许多研究证明,SCFAs在肠脑轴中的作用被广泛研究。认知能力下降是2型糖尿病(Type 2 diabetes,T2D)的并发症之一。间歇性禁食(Intermittentfasting,IF)是一种有希望缓解T2D症状的饮食干预。有研究用28天的糖尿病间歇性饮食小鼠模型进行探究,发现间歇性饮食可以降低小鼠的血糖,改善胰岛素抵抗(图e-h),从i、j图可以看出认知功能的改善。右图能量代谢相关通路蛋白表达增加,表明间歇性饮食能增强小鼠能量代谢和线粒体功能。
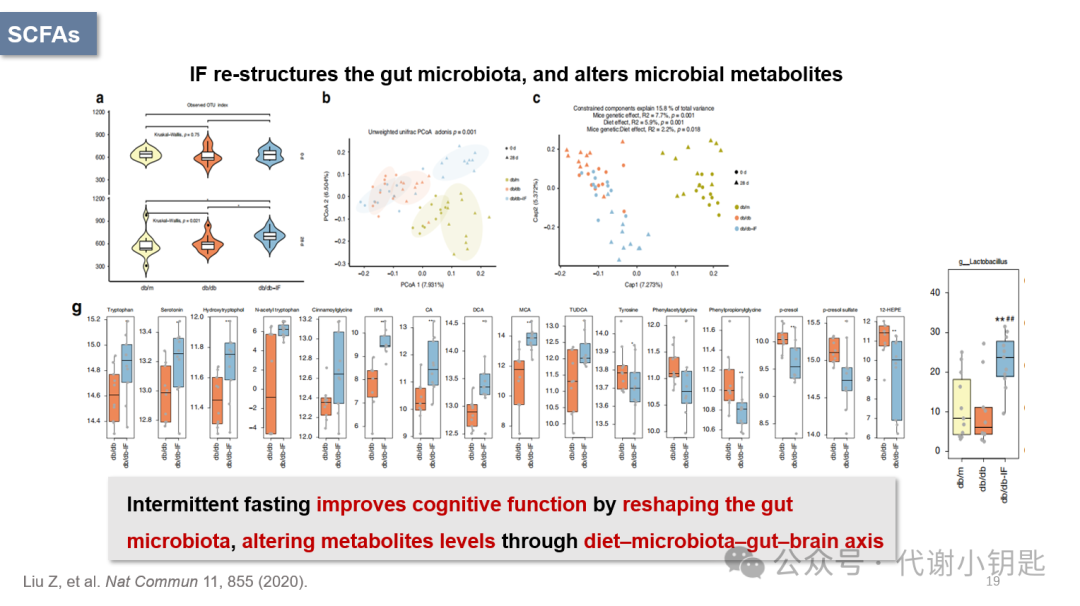
从图a、b、c中可以看出间歇性饮食改变了菌群丰度和肠道菌群的多样性,图g表明间歇性饮食极大程度改变了各肠道菌群代谢物。以上研究结果证明IF可以通过重组肠道微生物群,改变微生物代谢物水平,通过微生物-代谢物-脑轴改善认知功能障碍。
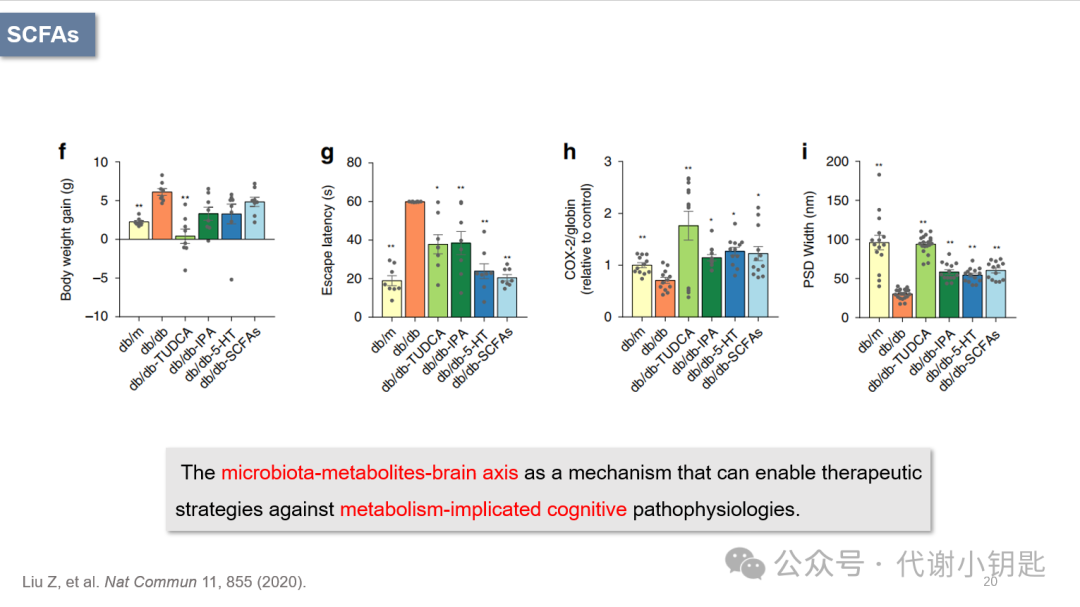
在改善认知功能方面,回补3-吲哚丙酸、五羟色胺(5-hydroxy tryptamine, 5-HT)、SCFAs或牛磺酸去氧胆酸显示出与IF相似的效果。该研究表明,微生物群-代谢物-脑轴是治疗代谢相关脑部的有效策略。

胆汁酸(Bile acids,BAs)是胆汁的重要成分,在脂肪代谢中起着重要作用。除了消化功能外,胆汁酸还作为从肠道内进入大脑的有效信号分子,通过激活FXR受体和质膜TGR5受体,影响全身脂质、胆固醇和葡萄糖代谢,以及能量和免疫稳态。有研究显示,西方饮食WD增加小鼠体重、血清胆固醇、血清ALT水平,提示肝损伤(图C)。长期摄入WD激活了ERK1/2,并降低了大脑中的突触后密度-95蛋白(Postsynaptic density protein-95,PSD95),提示突触后损伤。此外,WD摄入导致脑、肝、血内BAs谱的改变(图E),mRNA水平显示Fxr表达减少(图F)。
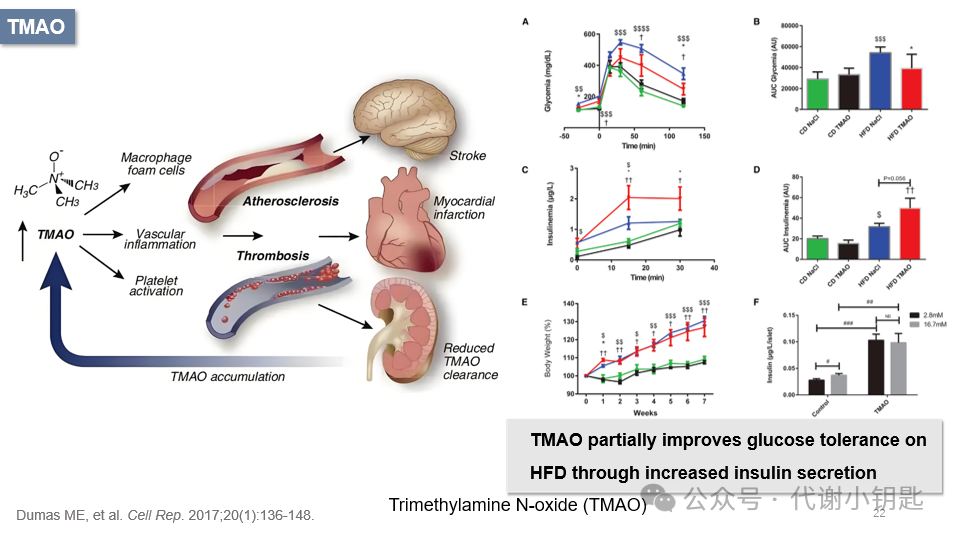
三甲胺N-氧化物(TrimethylamineN-oxide ,TMAO)是一种由膳食鱼类、肉类和脂肪分解产生的代谢物,其前体是三甲胺(TMA),由肠道微生物代谢产生。TMAO水平升高,与血管功能障碍的风险增加有关,包括中风,导致血管认知障碍,也影响胆固醇代谢,炎症和氧化应激。但也有研究表明,TMAO能降低小鼠血糖,升高胰岛素水平,降低体重,提示其在预测和调节肥胖、葡萄糖耐量、促进胰岛素分泌和降低代谢应激方面起着重要作用(图A-F)。
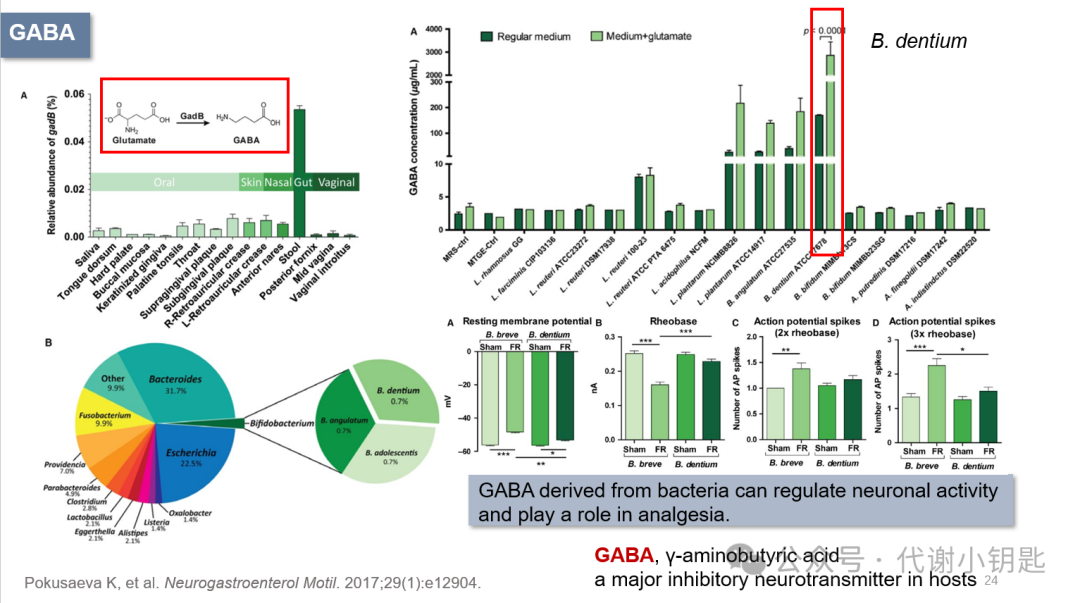
人类和细菌都具有将谷氨酸转化为GABA的能力,这是宿主体内主要的抑制性神经递质,大肠杆菌和乳酸杆菌等都能够产生GABA。GadB是一种能产生GABA的主要细菌酶(谷氨酸脱羧酶),A图宏基因组数据表明在96个健康成人个体的不同身体部位发现的微生物基因组中gadB的相对丰度,发现在粪便中含量最高,B图估计了健康人类肠道微生物组成员中谷氨酸脱羧酶的情况,并确定对双歧杆菌进行进一步研究。随后作者探究了不同细菌的GABA生成能力,发现B. dentium最强。后续研究发现,细菌来源的GABA能通过调节静息电位和不同基强度下动作电位大小来调节神经元活动,起到镇痛的作用(图A-D)。
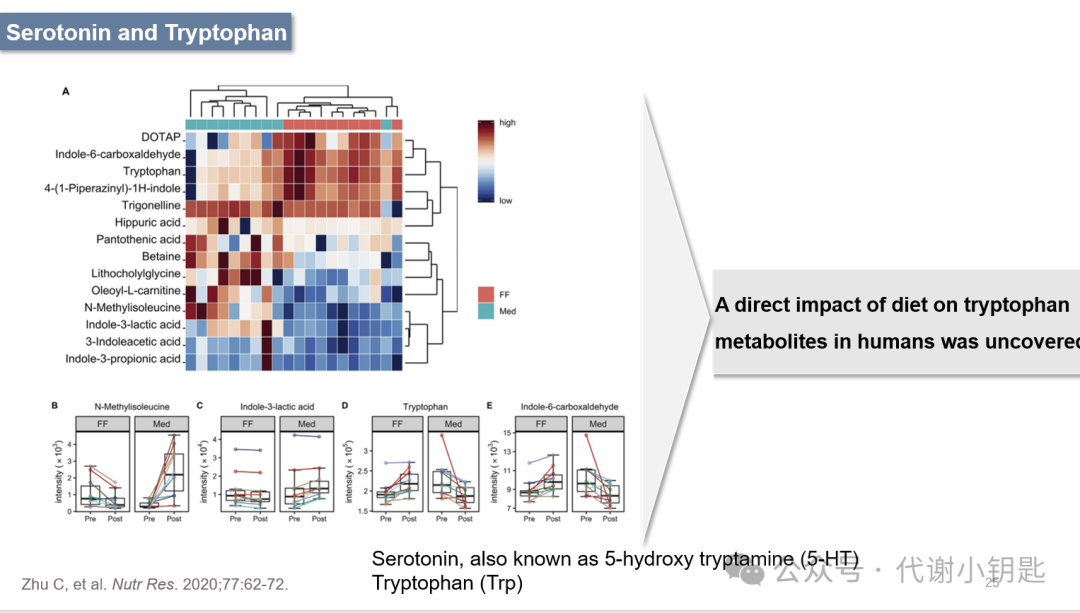
血清素,也被称为5-羟色胺(5-hydroxytryptamine ,5-HT),对宿主的行为和胃肠道功能至关重要,与肠道微生物群有着复杂的联系,对肠道和大脑都有重要意义。有研究观察到食用地中海饮食和快餐饮食导致对色氨酸代谢物的不同影响,伴随着地中海饮食下N-甲基异亮氨酸、吲哚乳酸的升高以及色氨酸和吲哚甲醛的减少。证明了饮食对人类色氨酸代谢物的直接影响。

与低色氨酸饮食相比,食用高色氨酸饮食4天可显著增加积极情绪,减少抑郁和焦虑症状。这些影响可能是由于受营养摄入影响的血清素水平的增加。以上证明饮食中的色氨酸对情绪和情感障碍有积极的影响。

最后是免疫途径。有研究发现,WD喂养的小鼠在大脑、回肠、肝脏、脂肪组织和脾脏中的炎症信号通路增加(图D),并伴随着小胶质细胞的激活(图A-B)和突触损伤(图C)。以上证明西方饮食加剧神经炎症和突触后损伤,而这通常被认为是导致认知能力下降的病理机制的基础。
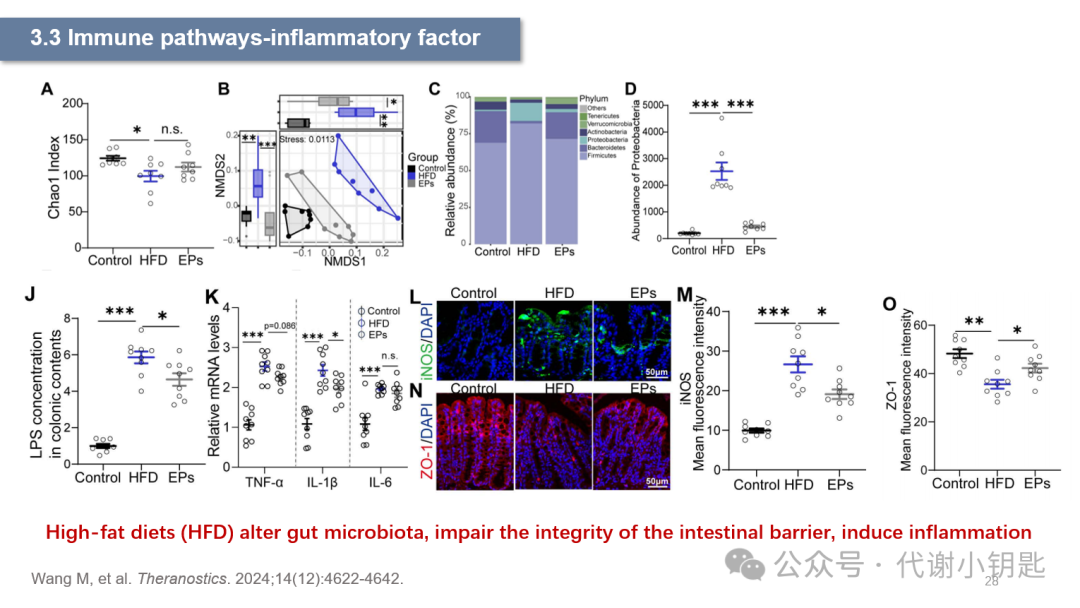
有研究表明,高脂饮食(High-fatdiets,HFD)28天的C57BL/6小鼠肠道菌群多样性被改变(图A、B),变形菌门丰度的显著上升(图C、D),诱导型一氧化氮合酶(induciblenitric oxide synthase,iNOS)正常情况下表达量较低,在促炎因子增多时iNOS表达量会上升,图M和图K共同表征HFD诱发炎症反应。此外,图J还表面HFD诱导肠道通透性的增加,ZO-1是一种紧密连接蛋白,图O表示HFD下ZO-1蛋白表达的减少,说明HFD还损伤肠道屏障的完整性。
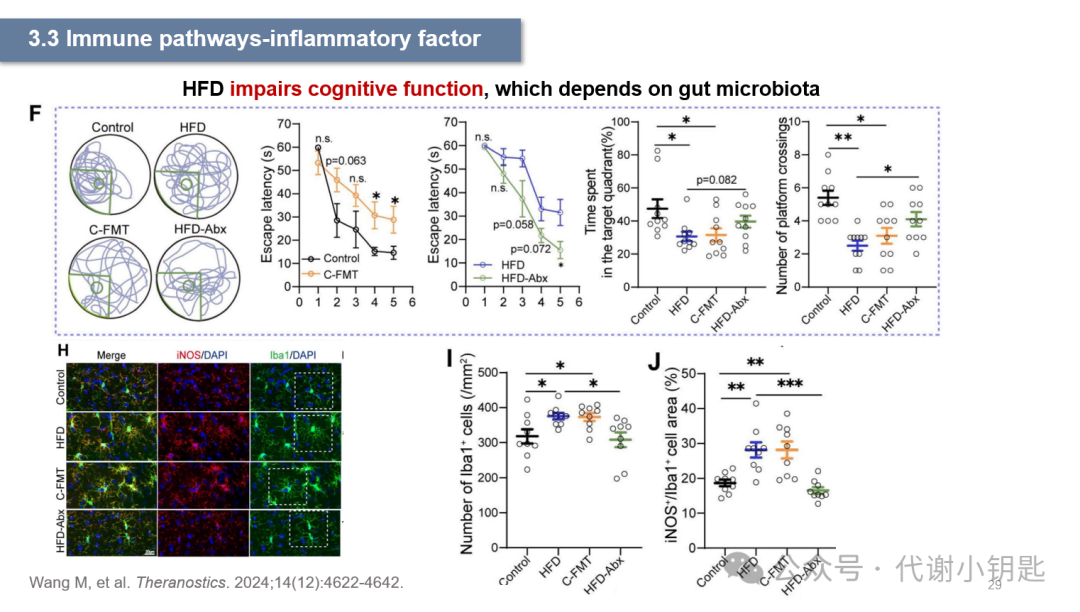
从F图可以看到,HFD加重小鼠的学习记忆能力障碍,主要体现在水迷宫实验中小鼠找到平台的时间显著长于对照组,以及在目标象限中花费时间的减少。Iba1(Ionizedcalcium-binding adapter molecule 1) 在中枢神经系统的小胶质细胞中特异性表达,因此被用作小胶质细胞的标记物。图H、I、J表明HFD下小胶质细胞的活化。而经过粪便移植实验(FecalMicrobiota Transplantation,FMT),在对照组小鼠移植了HFD小鼠的粪便后,也出现了上述相同的结果,在利用抗生素(Abx)清除肠道菌群后HFD的影响消失,说明HFD造成的小鼠神经元和认知功能的损伤依赖于肠道菌群。
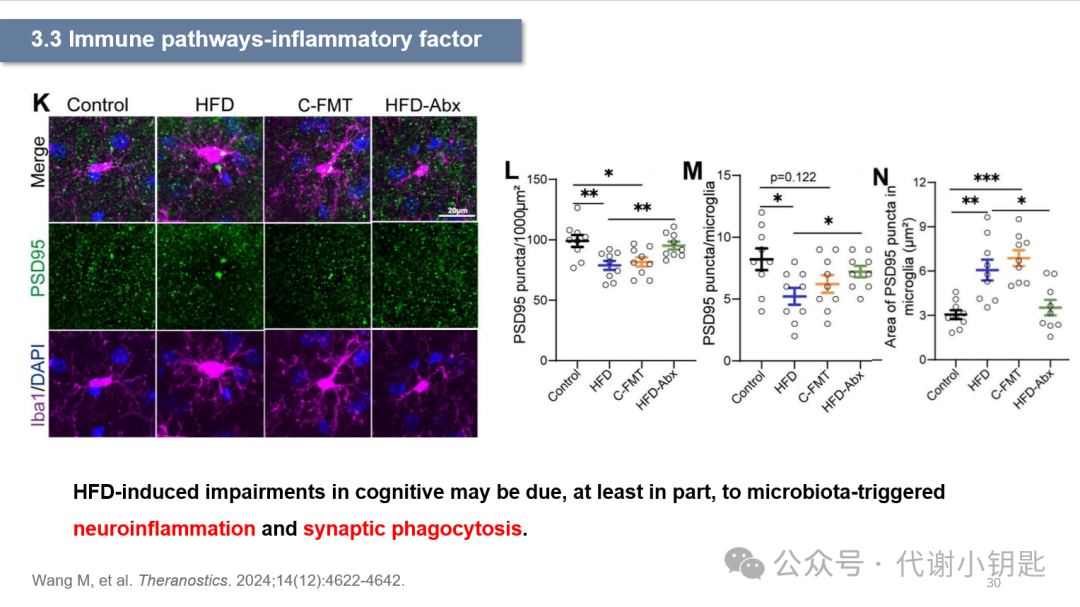
上文提到,PSD95是突触后密度蛋白,它表达量的降低提示着突触损失。研究中发现HFD下,PSD95的减少,提示突触损伤(图K、M)。同时,图N表示在HFD下,小胶质细胞对突触的的吞噬和包裹作用。综上所述,这些结果突出了肠道微生物群在介导小胶质细胞吞噬神经元突触中的关键作用,并提示HFD诱导的认知障碍可能至少部分原因是微生物诱导的的神经炎症和突触吞噬。而这种作用也被证明依赖于肠道菌群。
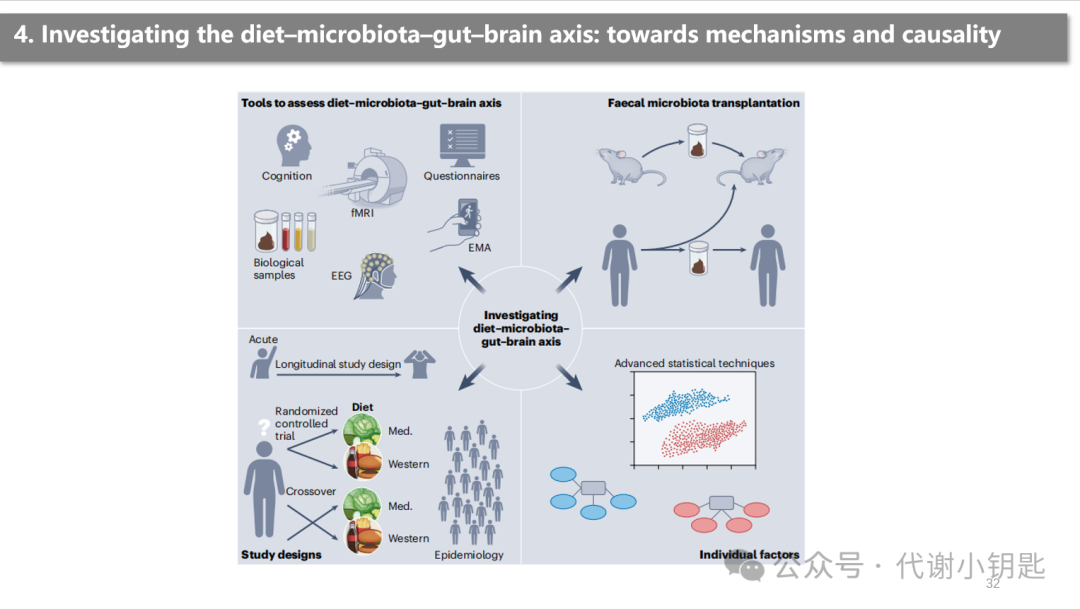
最后,作者其实是对现有的对饮食-肠脑轴的研究方法进行一个汇总,食物摄入对人类行为的影响可以通过结合脑神经成像技术,如核磁共振成像和脑电图记录与情绪和认知表现的行为评估来研究,还有各种行为学的评分。还应收集生物样本(即血液、唾液、尿液和粪便),以确定其作用机制。另一个方法上的限制是对食物摄入量的准确和方便的评估。常见的方法包括自我报告方法,如食物日记,24小时饮食回忆和食物频率问卷,但依旧存在局限性。此外,一些食品,如发酵食品,还没有特定的生物标志物,可能从生物信息角度,如从粪便样本测序中估计膳食摄入量。
总结
①本综述全面探讨了饮食、肠道微生物组成与功能之间的相互作用,以及它们对认知和情绪功能的影响;② 肠道微生物组的组成和功能受饮食因素的强烈影响,进而改变肠-脑信号传递;③ 肠脑轴信号传递具有多条通路,对于疾病的研究与药物探索意义重大。
联系人:吴晨雪
手机:15602945134
电话:0755-32960208
邮箱:rosellebio@126.com
地址: 广东省深圳市盐田区壹海中心1203室