
这篇文章是一篇综述,标题为《Intestinal colonization resistance in the context of environmental, host, and microbial determinants》,作者是Simon Woelfel、Marta Salvado Silva和Bärbel Stecher。文章发表在《Cell Host & Microbe》杂志上,日期为2024年6月12日。综述主要讨论了人类胃肠道(GI)中的微生物群落如何通过一种称为定植抗性(colonization resistance, CR)的机制来防御病原体。文章强调了以下几个关键点:
1.定植抗性(CR):CR是一种由肠道微生物群落提供的保护机制,能够阻止病原体在肠道中的定植和生长。
2.微生物群落的作用:肠道微生物群落的组成和生态学特性在个体之间存在显著差异,这些差异导致了不同水平的CR。
3.CR的机制:CR并非由特定的微生物类群决定,而是源于微生物与宿主之间的动态相互作用,并受到代谢、免疫和环境因素的影响。
4.研究进展:近年来,随着下一代测序技术、无菌小鼠模型和细菌培养技术的发展,我们对CR的底层机制和微生物间复杂相互作用的理解有了显著提高。
5.环境、宿主和微生物因素:文章讨论了环境因素(如饮食习惯、药物使用)、宿主因素(如遗传、发育、生理和免疫因素)以及微生物因素如何共同塑造CR。
6.研究展望:文章提出了未来研究方向,以进一步阐明宿主、微生物群落和环境因素之间的复杂关系,以及这些因素如何共同作用于保护人类免受GI感染。
7.微生物机制:详细讨论了微生物群落如何通过资源竞争和干扰竞争直接干扰病原体在肠道中的生长。
8.CR的生态学视角:文章从生态学的角度解释了CR,强调了环境条件对微生物表现和行为的影响。
9. CR的临床意义:CR的概念对于理解个体对感染的敏感性以及开发预防和治疗肠道感染的策略具有重要意义。
背景介绍
1.胃肠道(GI)微生物群落的重要性:GI道是人体最大的黏膜表面,由密集的微生物群落所栖息。这些常驻微生物群落的基本作用是保护宿主免受细菌病原体的侵害。
2.定植抗性(Colonization Resistance, CR):CR是一种保护机制,由肠道微生物群落提供,防止病原体在肠道中定植。这一功能在从低等动物到人类的不同生物中普遍存在。
3.CR的科学证据:CR已在多种人类病原体中得到证实,包括通过食物和水传播的病原体,如沙门氏菌、致病性大肠杆菌、痢疾杆菌、弯曲杆菌、霍乱弧菌和李斯特菌等。
4.肠道微生物群落的干扰:严重的肠道微生物群落破坏,无论是通过抗生素使用、多样性减少还是完全缺失(如在无菌动物中观察到的),都会促进这些肠道病原体的生长。
5.微生物群落组成的变异:即使在健康的宿主中,微生物群落组成的变异也会导致不同程度的CR,这表明微生物组可以作为CR的一个指标,为个体对感染的敏感性提供洞见。
6.CR的复杂性:CR不仅仅由微生物群落中特定成员的存在或缺失决定,而是由微生物与宿主在GI道特定环境中的复杂相互作用所塑造。
7.CR研究的技术进步:过去十年中,CR机制的研究从微生物组研究领域的模型和技术的扩散中显著受益,包括下一代测序技术、无菌动物模型、细菌培养以及人类和动物粪便微生物群移植(FMT)的协议。
8.CR的新视角:曾经简单的观念——即存在普遍保护性的微生物类群,通过刺激免疫防御、直接竞争或对病原体的拮抗来提供CR——正在向以社区为中心的概念转变。在这个不断发展的范式中,CR是由与宿主动态互动并根据代谢、免疫和物理化学环境发生功能性变化的复杂微生物相互作用网络所产生。
9.生态学的上下文依赖性:文章提到了生态学中的上下文依赖性概念,即生态关系的变化取决于关系发生或被观察的条件。
10. CR研究的未来方向:文章强调了未来研究需要解决的挑战,包括理解细菌表型、它们在微生物网络中的角色以及它们与宿主的关系,并提出了推动微生物组研究的机理理解、预测能力和普适性的必要性。
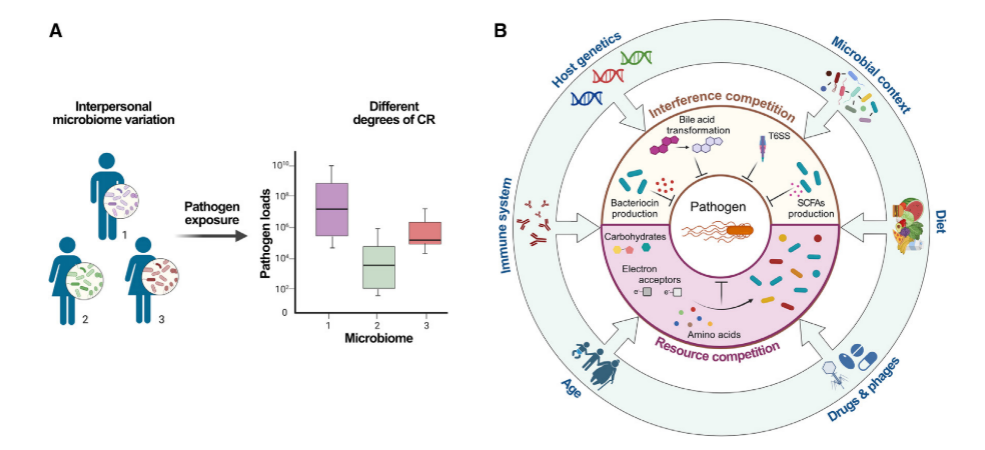
肠道微生物群落的定植抗性机制
这一部分主要讨论了肠道微生物群落如何通过以下机制来实现定植抗性(Colonization Resistance, CR):
1.资源竞争(Resource competition):肠道微生物群落与入侵的病原体竞争有限的营养物质,如碳水化合物、氨基酸、铁、微量元素和电子受体。这些资源对于病原体的生长至关重要。文章提到了Rolf Freter提出的营养生态位概念,即肠道细菌群落的组成主要由关键限制性营养物质的可用性决定。
2.干扰竞争(Interference competition):这包括了肠道微生物群落通过产生抗菌物质(如细菌素和VI型分泌系统)来直接限制病原体的生长或导致其死亡。这些抗菌物质可以是窄谱或广谱的,并且可以独立于或依赖于接触来诱导杀菌。
3.微生物代谢产物的作用:例如短链脂肪酸(SCFAs)和胆汁酸,这些代谢产物源自宿主,但被微生物群落修饰,它们在CR中发挥作用。
4.病原体毒力因子的干扰:微生物群落可以通过干扰病原体毒力因子的表达和功能来阻止感染,从而减少病原体引起疾病的能力。
5.特定微生物与CR的关系:文章详细讨论了特定微生物如何通过上述机制参与CR,例如某些益生菌和病原菌之间的相互作用。
6.微生物群落的适应性:肠道微生物群落能够根据环境信号调整其代谢和行为,这对于在动态的哺乳动物肠道生态系统中生存至关重要。
7.环境条件的影响:文章强调了环境条件,如微生物群落的整体组成、饮食习惯、药物使用以及宿主相关的决定因素(包括遗传、发育、生理和免疫因素)对CR机制的深刻影响。
8.微生物群落的动态互动:CR是由微生物之间复杂的互动网络动态地与宿主互动,并根据代谢、免疫和物理化学环境发生功能性变化的结果。
9.生态学的上下文依赖性:文章还讨论了生态学中的上下文依赖性,即生态关系的变化取决于关系发生或被观察的条件。
资源竞争
这一部分主要讨论了肠道微生物群落如何通过竞争有限的营养物质来阻止病原体的生长和定植。以下是这部分内容的几个关键点:
1.营养生态位概念:文章引用了Rolf Freter提出的营养生态位概念,指出肠道细菌群落的组成主要受关键限制性营养物质的可用性影响。入侵物种只有比现有群落更有效地消耗至少一种限制性营养物质,才能成功在肠道中定植。
2.共生菌的专业化:共生菌发展了利用不同资源的专业化能力,包括碳水化合物、氨基酸、维生素和矿物质。它们可以适应在多样化的群落******享资源,共同消耗所有可用的营养物质。
3.病原体与共生菌的资源竞争:例如,Citrobacter rodentium(一种模拟人类致病性大肠杆菌的鼠肠道病原体)在无菌小鼠肠道中利用可用的氨基酸,但在复杂微生物群落存在时则转向氨基酸生物合成途径。
4.竞争排除原理:研究表明,与病原体共享营养生态位的共生菌通过竞争排除病原体在肠道中的生长,对CR至关重要。
5.营养源的重叠:社区多样性与宿主健康之间的相关性,特别是对肠道病原体的抵抗力,可以通过“碳水化合物阻断原理”来预测,即与病原体营养源重叠越大,社区提供的保护越强。
6.特定营养物质的影响:某些营养物质如糖醇(例如半乳糖醇和山道醇)可以作为病原体的专有营养源,促进其生长和毒素产生,从而影响CR。
7.电子受体的竞争:肠道中的兼性厌氧性肠道病原体在存在氧气或替代电子受体(如硝酸盐、四硫酸盐和延胡索酸)时生长得更好,这些电子受体使它们能够进行厌氧呼吸。
8.维生素和矿物质的竞争:文章还讨论了维生素的合成、矿物质(如铁和锌)的竞争,以及这些因素如何影响病原体在肠道中的初期生长。
干扰竞争:抗菌武器的产生
这一部分主要讨论了肠道微生物群落如何通过产生抗菌物质来直接或间接地干扰病原体,从而增强定植抗性(CR)。以下是这部分内容的关键点:
1.抗菌物质的多样性:共生菌释放具有不同生物活性的小分子,这些物质可以调节免疫系统,也可以抑制其他细菌。
2.细菌素的作用:细菌素是微生物群落产生的最研究和记录的天然产物之一。它们在塑造肠道菌群中起着重要作用,细菌可以使用它们来针对占据相似生态位的竞争对手或不同门中的细菌。
3.特定细菌素的例子:例如,Blautia producta产生的lantibiotic能够减少万古霉素耐药性肠球菌(VRE)的定植,而对其他共生菌的影响较小。
4.Reuterin的抗菌作用:Limosilactobacillus reuteri(L. reuteri)释放一种名为3-羟基丙醛的广谱抗菌物质,通常称为reuterin,它通过诱导氧化应激和膜损伤来抑制C. difficile的生长。
5.细菌素的表达调控:抗菌化合物的表达通常受到严格的调控。一些细菌素只在细菌的亚群中产生,因为它们的释放通常伴随着细菌的裂解。
6.环境信号的影响:激活细菌素表达的环境信号包括营养限制、细胞损伤和压力。因此,环境背景在细菌素介导的竞争中起着重要作用。
7.VI型分泌系统的利用:除了释放抗菌化合物外,细菌还可以通过VI型分泌系统(T6SS)以接触依赖的方式杀死其他细菌。一些病原体利用T6SS来促进感染,而共生菌则可以使用它们来对抗肠道病原体。
8.干扰竞争的其他形式:文章还提到了其他形式的干扰竞争,例如某些细菌细胞毒素可以对细菌DNA造成损害,从而影响病原体。
9.抗菌物质的生态学意义:这些发现强调了研究肠道生态系统中成员的个体行为和相互作用的重要性,这些行为和相互作用塑造了病原体遇到的微生物环境。
产生抑制性代谢产物
这一部分主要讨论了共生细菌如何通过产生特定的代谢产物来改变肠道环境,从而抑制病原体的生长和活性。以下是这部分内容的关键点:
1.短链脂肪酸(SCFAs):特定共生细菌产生的SCFAs,如丁酸、丙酸和乙酸,是肠道微生物厌氧发酵的产物。这些代谢产物在决定肠道pH值方面起着关键作用,并能抑制肠道中某些微生物群体的生长。
2.SCFAs的作用机制:尽管SCFA介导的CR(定植抗性)的具体机制复杂,但研究表明,盲肠和结肠微生物群产生的酸性肠道环境以及SCFAs的增加是CR的关键条件。
3.胆汁酸的角色:胆汁酸是宿主产生的,但经过微生物群落的修饰。初级胆汁酸在肝脏中合成,并通过胆道系统输送到小肠。肠道微生物群落将这些结合的胆汁酸脱结合,产生甘氨酸、牛磺酸和脱结合的初级胆汁酸,这些可以被某些共生细菌进一步修饰生成二级胆汁酸。
4.胆汁酸对病原体的影响:特定的微生物群落成员通过胆汁盐水解酶(BSH)活性影响肠道的化学环境。某些BSH通过分解牛磺胆酸(一种触发毒力基因表达的结合初级胆汁酸)来减少病原体的定植。
5.微生物结合的胆汁酸(MCBAs):MCBAs是结合的胆汁酸通过共生细菌的酶活性重新结合形成的。它们对病原体如艰难梭菌的生长和孢子萌发有明显影响。
6.饮食对胆汁酸的影响:高脂饮食后的胆汁酸释放可以导致微生物群落的短暂破坏,从而减轻对病原体的CR。
7.病原体毒力因子表达的干扰:除了影响病原体的生长或活性外,微生物还可以直接或间接干扰病原体毒力因子的产生,从而减少其引起疾病的能力。
8.环境信号对毒力因子表达的调控:例如,艰难梭菌产生的两种毒素TdcA和TdcB的表达是由碳水化合物和氨基酸谱全局控制的,特定氨基酸如精氨酸的耗尽为艰难梭菌增强毒素表达提供了代谢信号。
干扰毒力因子表达
这一部分主要讨论了肠道微生物群落如何通过直接或间接的方式影响病原体毒力因子的表达,从而降低病原体引发疾病的能力。以下是这部分内容的关键点:
1.毒力因子表达的调控:病原体的毒力因子表达通常受到环境信号的严格调控。例如,艰难梭菌(Clostridioides difficile)产生的两种毒素TdcA和TdcB的表达是由碳水化合物和氨基酸的可用性控制的。
2.特定氨基酸的影响:精氨酸的耗竭被用作艰难梭菌增强毒素表达的代谢信号。精氨酸感应还涉及诱导Citrobacter rodentium(C. rodentium)和肠出血性大肠杆菌(EHEC)的致病性岛(pathogenicity islands)的表达。
3.微生物群落对毒力因子表达的影响:例如,Mucispirillum schaedleri(M. schaedleri)这种硝酸盐呼吸的共生细菌,通过消耗硝酸盐来抑制Salmonella Typhimurium(S. Tm)的毒力基因表达,硝酸盐在厌氧环境中作为触发S. Tm表达毒力基因的信号。
4.胆汁酸对毒力因子表达的影响:胆汁酸的种类也会影响多种病原体的毒力因子表达,包括S. Tm、艰难梭菌和霍乱弧菌(Vibrio cholerae)。
5.群体感应(Quorum sensing):这是一种细菌种群内以及不同细菌种群之间,甚至与宿主之间进行化学通讯的过程,它在调节毒力因子表达的时机和程度方面起着重要作用。
6.宿主遗传对肠道环境的影响:宿主的遗传背景如何影响肠道微生物群落的组成以及对病原体定植的敏感性,这是一个研究不足的领域。
7.年龄特定感染敏感性的特征:不同的人生阶段表现出独特的生理特征,这些特征影响微生物群落的组成和感染的敏感性。
8.分娩方式:分娩方式,如剖宫产(C-section),可能会影响婴儿早期微生物群落的稳定性,并可能影响感染的敏感性。
9.婴儿微生物群落的生态线索:尽管新生儿的微生物群落发育中存在细菌多样性的减少和某些门类的缺失,但潜在的病原体之间的种内和种间竞争很高,成人微生物群落的生态原则,如优先效应,对这一生态系统仍然很重要。
各种背景因素塑造了CR背后的机制
微生物环境
这一部分主要讨论了肠道微生物群落的组成和多样性如何作为一个整体影响定植抗性(CR),以及这些微生物环境因素是如何与宿主的生理和免疫系统相互作用的。以下是这部分内容的关键点:
1.微生物群落的多样性和组成:肠道微生物群落的多样性和组成被称为微生物环境,它们是影响CR的主要因素之一。
2.生活方式的影响:人类的生活方式,特别是工业化水平,对微生物群落的组成和功能潜力有显著影响,这与社会因素、饮食变化、生活水平、整体健康状况和药物使用紧密相关。
3.工业化进程:工业化与进化上保守的核心微生物群落的丧失和生物多样性的普遍下降有关,这些变化可能与欧洲国家普遍的高糖饮食有关。
4.地理差异:地理差异与微生物群落的组成有关,这可能会影响对特定病原体的CR。
5.微生物群落的相互作用:CR通常不能归因于单一的微生物种类,而是微生物群落中多个成员以依赖于上下文的方式相互作用的结果。
6.优先效应:在微生物群落的组装中,早期定植的物种可能会通过资源耗竭、代谢物交叉喂养或环境调节等方式,影响后续物种的定植能力。
7.营养位的抢占和修改:早期定植的微生物可能会通过耗尽生长限制性资源或改变可用的营养位,来限制病原体的定植或影响其生态位。
8.交叉喂养:在复杂的细菌群落中,营养位的交叉喂养是一种合作的代谢互动,成员之间交换代谢产物,这可以增强CR或为病原体提供营养。
9.宿主遗传与微生物群落:宿主的遗传背景如何影响肠道微生物群落的组成和对病原体的敏感性,是一个研究不足的领域。
10.年龄特定特征:不同的人生阶段,如婴儿期和老年期,具有影响微生物群落组成的特定生理特征,这些特征可能会影响对感染的敏感性。
优先效应影响细菌入侵的机会
这一部分主要探讨了在微生物群落中,早期定植的微生物如何通过所谓的“优先效应”影响后续物种的定植能力和病原体的入侵潜力。以下是这部分内容的关键点:
1.优先效应的定义:优先效应指的是在微生物群落组装过程中,早期定植的物种可能会通过一系列机制来影响后续物种的定植,这些机制包括资源的抢占、生态位的修改或环境条件的调节。
2.资源抢占:早期到达的微生物会消耗限制性资源,从而使得具有相似生态位的晚期到达物种难以定植。这种抢占是基于“先到先得”的原则。
3.生态位修改:早期定植的物种可以通过代谢活动改变环境条件,从而为后续物种的定植创造有利或不利的条件。例如,它们可以分解复杂碳水化合物为更易获取的糖类,或者产生酸性环境来排斥潜在的病原体。
4.环境调节:早期定植的微生物可以通过改变pH值或其他环境因素来影响后续物种的生长条件。
5.微生物群落的稳定性:稳定的微生物群落已经占据了大多数生态位,因此与新入侵的物种之间的相互作用主要是抑制性的。
6.病原体的适应性:研究表明,病原体能够根据不同的微生物环境调整其底物范围,从而适应不同的微生物环境。
7.交叉喂养:在微生物群落中,初级降解者发酵复杂多糖并释放中间产物,这些产物可以被次级发酵者转化为最终产物,如乙酸、丙酸和丁酸。这种交叉喂养关系增强了合成细菌群落的稳定性。
8.微生物群落对病原体的影响:早期定植的微生物可以通过交叉喂养或产生抑制性代谢产物来支持保护性共生菌的增殖,或者为病原体提供营养源。
9. 微生物群落的动态变化:微生物群落的动态变化和相互作用对病原体的入侵和定植具有重要影响,这些相互作用是上下文依赖性的,意味着它们会受到环境条件的影响。
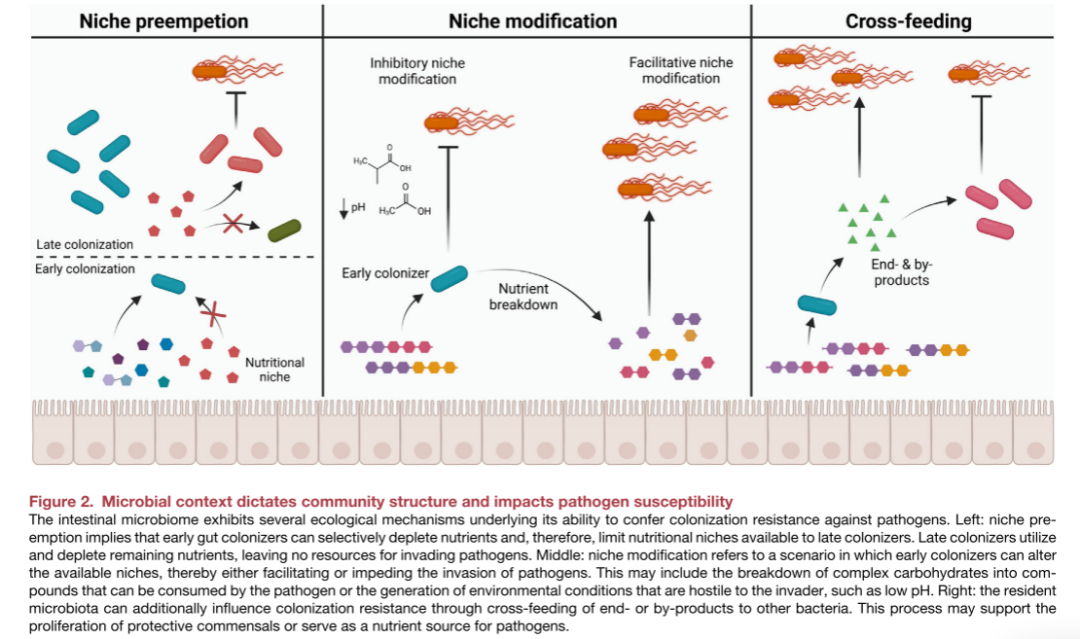
交叉喂养
这一部分主要讨论了在复杂细菌群落中,不同细菌成员之间通过交换代谢产物来相互影响,这种代谢物的交换如何影响整个微生物群落的结构和功能,以及它们如何对病原体的定植和宿主的健康产生影响。以下是这部分内容的关键点:
1.代谢物交换:在微生物群落中,初级降解者发酵复杂多糖并释放中间代谢产物,如甲酸、乳酸、琥珀酸等,这些可以被次级发酵者进一步转化为最终产物,如乙酸、丙酸和丁酸。
2.合作代谢互动:交叉喂养是细菌群落中的一种合作代谢互动形式,涉及细菌群落成员之间的代谢产物或副产品的交换。
3.营养和能量的共享:交叉喂养允许细菌共享营养和能量,这有助于增强群落的稳定性和抵御外来病原体的能力。
4.实验确认的例子:文中提到了一些实验上确认的交叉喂养的例子,包括维生素、氨基酸和二羧酸的交换。
5.病原体的受益:某些情况下,病原体可以从共生菌的代谢产物中受益,例如,某些氨基酸和多胺可以增加艰难梭菌在肠道中的适应性和定植能力。
6.增强定植抗性:交叉喂养还可以加强定植抗性,例如,乳酸菌和梭菌之间的合作可以增强对多重耐药的肠杆菌科细菌的抵抗力。
7.微生物群落的合成:交叉喂养的概念对于设计功能性的活生物治疗剂具有潜在的应用价值,这些治疗剂可以用于精确调节微生物群落。
8.微生物群落的动态平衡:交叉喂养是微生物群落内部动态平衡的关键因素,它可以影响群落对病原体的抵抗力和宿主的健康状态。
9.环境因素的作用:环境因素,如营养可用性和代谢物的产生,可以影响交叉喂养的效率和结果。
饮食对定植抗性的影响:滋养微生物群落、宿主还是病原体?
这一部分主要探讨了饮食如何通过不同的机制影响肠道微生物群落、宿主和病原体,进而影响定植抗性。以下是这部分内容的关键点:
1.饮食对微生物群落的影响:饮食成分可以直接或间接改变肠道微生物群落的组成,从而影响其对病原体的抵抗力。
2.营养景观的改变:饮食可以显著改变肠道的营养景观,为微生物群落提供不同的营养源,这些营养源可以是益生元,也可以是病原体的专有营养源。
3.益生元的作用:某些食物成分,如膳食纤维、益生元和黏液糖蛋白,是微生物群落的营养来源,特别是对于有益的共生菌。
4.特定多糖的利用:一些多糖,如菊粉和果聚糖,可以作为益生元,促进有益菌群的生长,增强对病原体的抵抗力。
5.饮食对病原体的促进作用:某些营养成分可能不会被共生菌或宿主利用,但可能成为病原体的专有营养源,促进其生长。
6.饮食对黏膜屏障的影响:饮食成分还可以改变肠道的黏膜屏障、上皮细胞代谢和免疫反应。
7.特定饮食成分的影响:例如,乳糖可以被某些细菌利用,促进它们的生长,而纤维的缺乏则可能导致黏膜屏障的减弱。
8.饮食添加剂的影响:食品添加剂,如乳化剂和非营养性甜味剂,也可以直接改变细菌群落的密度、组成和基因表达。
9.饮食与免疫系统的相互作用:个体的饮食模式也会影响其对入侵病原体的免疫反应,包括黏膜免疫和细胞免疫。
10.饮食限制和禁食:饮食限制和禁食可以通过减少细菌总量来影响对病原体的抵抗力,并且可能通过干扰病原体的毒力基因表达来增强定植抗性。
膳食纤维、益生元和黏膜屏障衍生的糖蛋白为微生物群落提供营养源
这一部分主要讨论了以下内容:
1.膳食纤维的作用:膳食纤维是植物性食物中的复杂碳水化合物,它们在肠道中不易被宿主消化酶分解,但可以被肠道微生物群落中的特定细菌发酵利用。
2.益生元的特性:益生
联系人:吴晨雪
手机:15602945134
电话:0755-32960208
邮箱:rosellebio@126.com
地址: 广东省深圳市盐田区壹海中心1203室