牙泰中草药体内消毒防疫修复制剂助力守护世界平安
肠道微生物组与自闭症谱系障碍(ASD)之间的关系已经被广泛研究,但大多数研究都集中在细菌组成上,肠道古菌、真菌和病毒,或肠道微生物群的功能之间的联系。 7月8日香港中文大学黃秀娟教授团队在Nature Microbiology[IF: 20.5]期刊发表题为“Multikingdom and functional gut microbiota markers for autism spectrum disorder”的研究成果。

该研究通过宏基因组测序分析了1627名儿童的粪便样本,并结合大量表型数据,揭示了自闭症谱系障碍(ASD)与肠道微生物群之间的复杂关联。研究发现,ASD儿童的肠道中14种古菌、51种细菌、7种真菌、18种病毒、27种微生物基因和12条代谢途径发生了改变;利用机器学习方法,构建了一个包含31个多界微生物和功能标记的模型,该模型在区分ASD儿童和神经正常儿童方面表现出卓越的诊断准确性,曲线下面积(AUC)为0.91;模型的准确性主要由泛醌-7或硫胺二磷酸酯的生物合成途径驱动,这些途径在ASD儿童中降低;该研究结果强调了多界和功能性肠道微生物群标记物作为 ASD 非侵入性诊断工具的潜在应用。
研究背景
自闭症谱系障碍(ASD)是一种异质性神经发育障碍,以社交、认知和行为障碍为特征。虽然ASD的病因尚不清楚,但人们认为它与遗传和环境因素之间复杂的相互作用有关。在过去的十年中,肠道微生物组已被证明通过调节神经免疫网络和直接与大脑沟通在调节肠-脑轴中发挥核心作用,并可能有助于ASD的发展。临床前研究表明,患有ASD的儿童肠道微生物群组成发生改变。到目前为止,大多数研究都集中在肠道微生物群的细菌组成上,并揭示了ASD患儿肠道微生物多样性和组成的许多差异,尽管这些差异并不一致。宏基因组测序技术使得研究其他微生物群落成为可能,包括古菌,真菌和病毒也在人类肠道中定植,这些暗物质可能在ASD的发病机制中发挥关键作用。
在该项研究中,探索了肠道古菌、细菌、真菌、病毒及其基因和功能的多界分析,对1,627名被认为是神经典型或患有ASD的儿童进行了宏基因组分析,并提供了广泛的表型数据,并在237个粪便宏基因组的公共数据集中验证了发现。
研究对象
发现队列:1627名儿童,包括709名ASD儿童和374名神经典型(NT)儿童。
独立医院队列:82名ASD儿童和90名NT儿童(4-11岁)。
独立社区队列:116名ASD儿童和60名NT儿童(1-8岁)。
注意缺陷多动障碍(ADHD, n = 118)和特应性皮炎(n = 78)的非ASD儿童
公共数据集ASD vs NT: 121 vs 116
组学技术:宏基因组测序
研究结果
四个界中与自闭症相关的微生物种类
该研究共招募了来自5个独立队列的1,627名儿童(图1a)。收集了广泛的表型数据(236个因素),包括年龄、性别、体重指数(BMI)、饮食、药物、合并症、伴发精神疾病、胃肠道(GI)症状、家庭特征和相关的技术因素。
分析了236种宿主因素对肠道菌群组成的影响,以确定潜在的混杂因素(图1a)。在发现队列中(年龄3-12岁,n = 1083, 24.3%为女性),这些宿主因素的组合分别解释了古菌、细菌、真菌和病毒的12.5%、15.1%、10.7%和11.7%的个体间微生物组变异(图1b)。在所有研究的宿主和饮食因素中,共有21个因素对肠道微生物群组成有显著影响,包括ASD、年龄、性别、BMI、3个GI参数、15个饮食因素和测序批次,因此在随后的所有分析中都对这些因素进行了调整。
接下来,研究者评估了神经正常儿童和自闭症儿童之间肠道微生物群多样性的变化。与被认为是神经正常的儿童相比,ASD儿童的古生菌、细菌和病毒的多样性有所减少(图1c)。在神经正常儿童和ASD儿童中,共有14种古细菌、51种细菌、7种真菌和18种病毒显示出不同的丰度(图1d)。与被认为是神经正常的儿童相比,90种已鉴定的微生物物种中有80种的相对丰度在ASD儿童中显著降低(图1d)。这一发现在细菌群落中最为明显,在ASD儿童中,50种细菌种类减少,而只有一种细菌种类增加(图1d)。ASD患儿细菌种类的改变是由嗜热链球菌和产生短链脂肪酸的细菌(如拟杆菌属)的减少所驱动的。
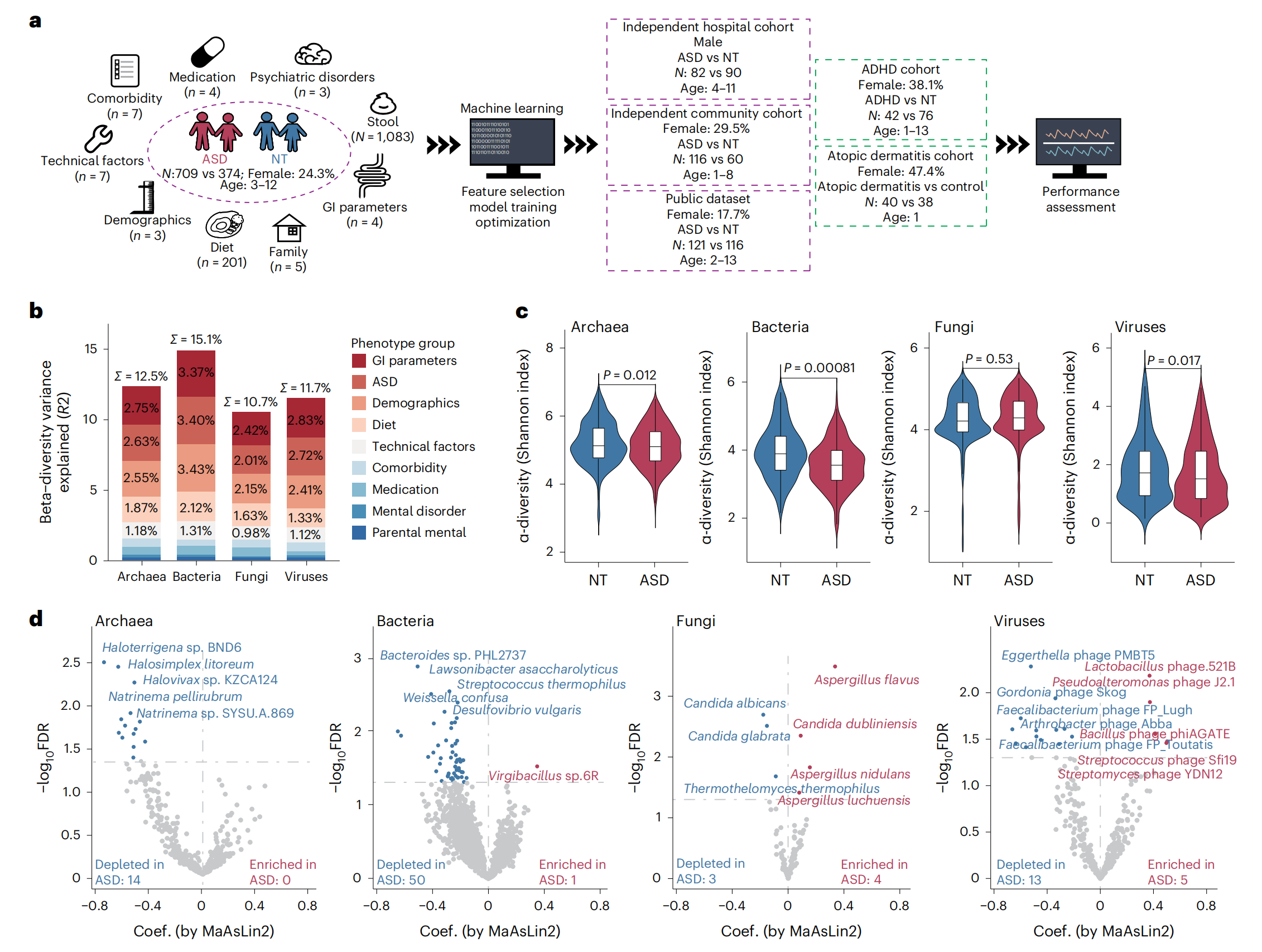
图1-ASD 与粪便微生物组成之间的关联
ASD患者肠道微生物群功能的改变
在功能层面,宿主表型因素分别解释了微生物组途径和微生物基因变异的 17.1% 和 15.7%(图2a)。ASD 诊断是导致微生物组途径和微生物基因变异的首要因素(图2a)。总共有 19 种宿主和饮食因素对肠道微生物组功能有显著影响,包括 ASD、年龄、性别、BMI、2 个 GI 参数、12 个饮食因素和测序批次。在调整这些混杂因素后,确定了 27 个差异KEGG 直系同源 (KO) 基因:与神经典型儿童相比,ASD 儿童中有 23 个减少,4 个增加(图2c)。在通路水平上,注意到 12 条差异通路,其中 9 条通路与 ASD 呈负相关,3 条通路与 ASD 呈正相关(图 2b)。研究者发现,与被认为是神经正常的儿童相比,患有自闭症的儿童的泛醇-7 和硫胺素二磷酸的生物合成途径减少(图2b)。泛醇具有抗氧化活性,已被证实能够改善患有自闭症的儿童的症状。在动物和人类研究中,硫胺素二磷酸合成障碍与自闭症和其他精神障碍有关。还观察到自闭症与4-氨基丁酸 (GABA) 的旁路通路之间存在负相关性。GABA 是哺乳动物中枢神经系统的主要抑制性神经递质,在之前的研究中与自闭症有关。
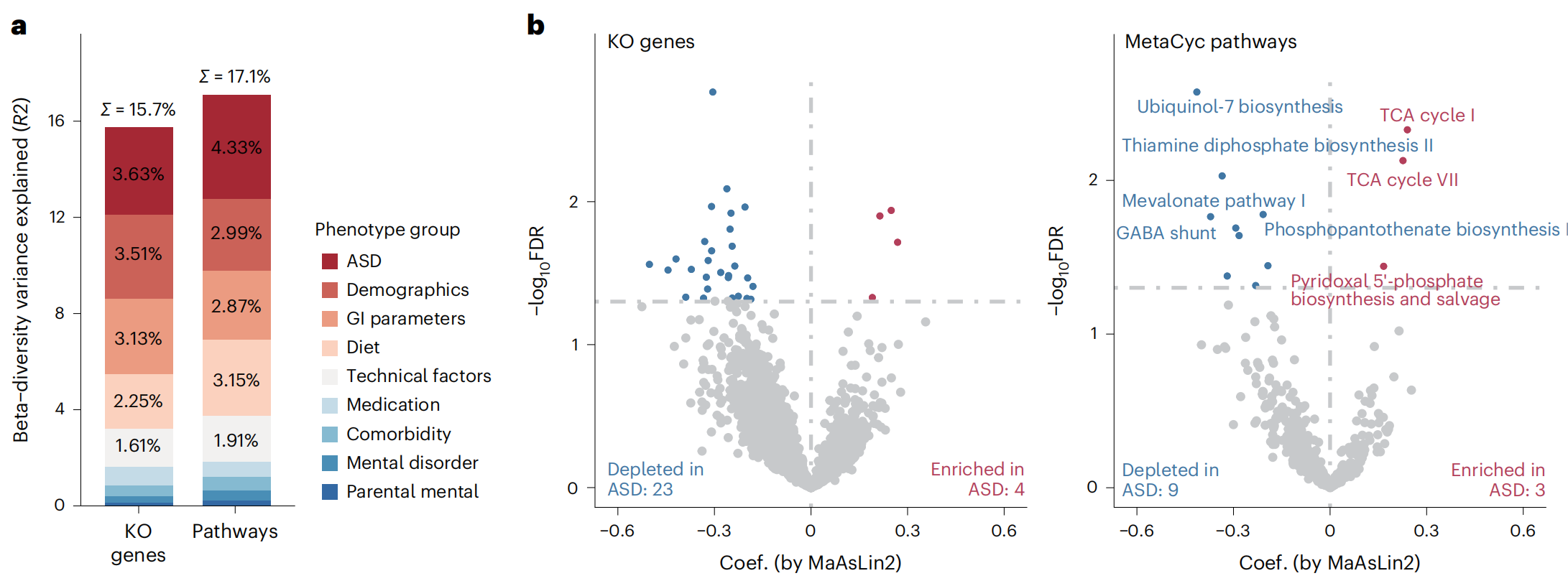
图2-ASD 与粪便微生物组功能之间的关联
用于 ASD 诊断的单一微生物界标记物
在匹配的队列中,首先测试了使用单一界标记区分 ASD 儿童和被认为是神经典型儿童的模型的准确性。在所有单一界标记中,微生物途径模型显示出检测 ASD 最强的预测能力,平均曲线下面积 (AUC) 为 0.87(图3b),其次是微生物基因(AUC 0.86)、细菌(AUC 0.85)、古细菌(AUC 0.76)、真菌(AUC 0.74)和基于病毒(AUC 0.68)的模型(图3b)。总的来说,研究结果表明,来自不同界的粪便微生物组标记为 ASD 诊断提供了有希望的预测能力。
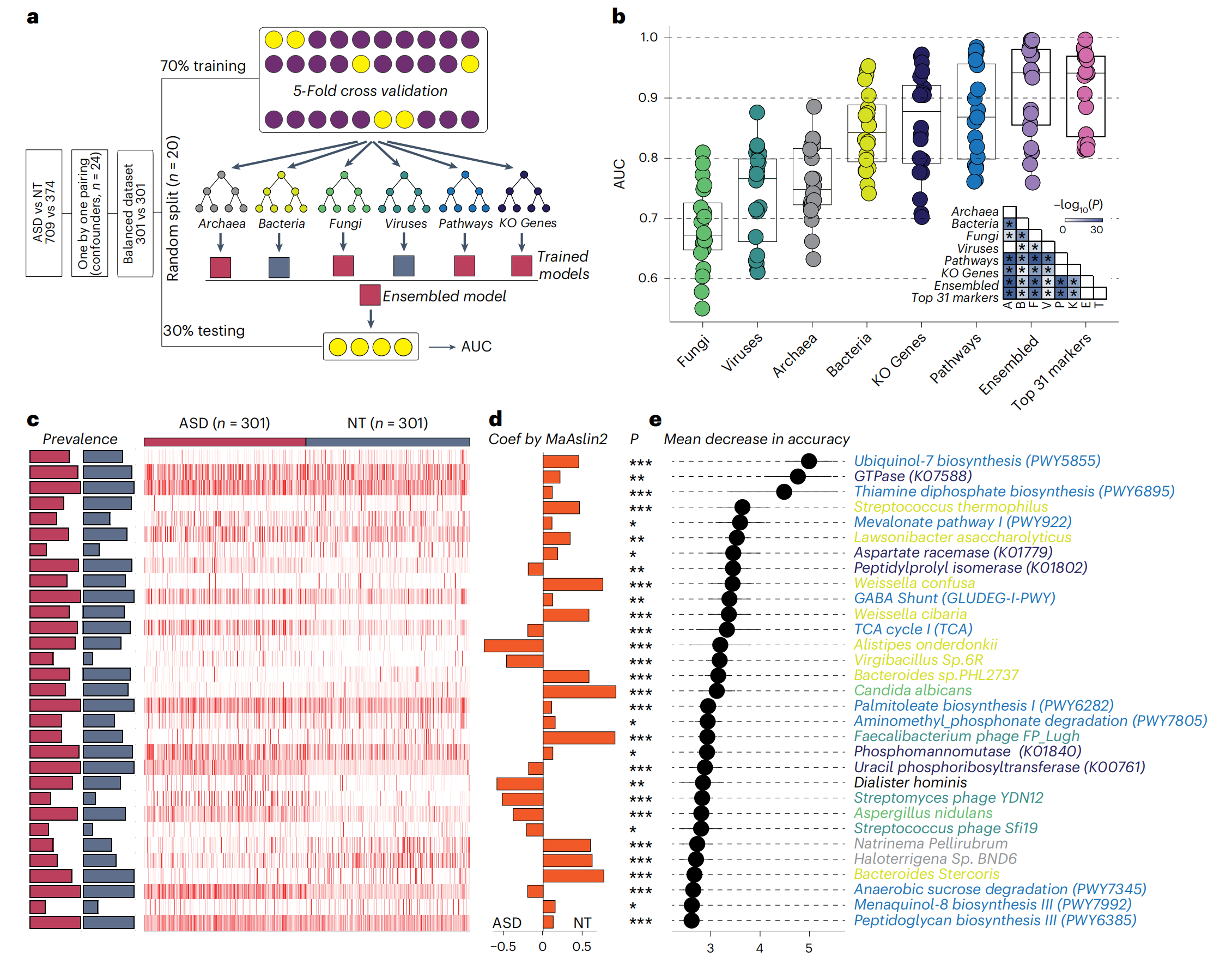
图3-用于诊断 ASD 的随机森林模型
用于 ASD 诊断的多界微生物标记物
接下来,研究者探索了结合多界特征的模型的性能,与基于单一界特征的模型相比,集成模型在 ASD 诊断方面表现出更优异的性能(平均 AUC 0.91)(图 3b)。为了确定达到最高精度的最少微生物组标记物数量,根据其排名将已识别的标记物连续纳入模型,最后,总共 31 个微生物特征在 ASD 诊断中的 AUC 为 0.91(图3b)。这 31 个标记物的流行率和相对丰度在被认为是神经正常的儿童和患有 ASD 的儿童之间存在显着差异(图3c)。根据 MasAsLin2,21 个标记物在患有 ASD 的儿童中显着减少,而 10 个标记物在患有 ASD 的儿童中显着富集(图3d)。重新分析了这 31 个特征的重要性,并观察到模型的准确性主要由泛醇-7 生物合成途径、GTP 酶和硫胺素二磷酸生物合成途径驱动(图3e),这支持了它们在 ASD 发病机制中的潜在作用。此外,几种细菌的消耗,包括Streptococcus thermophilus、Lawsonibacter asaccharolyticus,也是对诊断准确性有贡献的排名靠前的微生物特征(图3e)。总的来说,31 个粪便微生物组标记物组是一种有前景的非侵入性 ASD 诊断工具。
在独立队列和公共数据集中进行验证
为了从外部验证诊断价值并避免过于乐观地报告诊断准确性,研究者在一个独立的医院队列中测试了 31 个标记组。发现模型的 AUC 范围为 0.55 至 0.87(图 4a)。其中,使用 31 个标记的集成模型在 AUC 中排名第一,为 0.87,灵敏度为 91%,特异性为 73%(图4a)。31 个标记中的 28 个标记的相对丰度在被认为是神经正常的儿童和患有 ASD 的儿童之间仍然显着不同(图4b)。此外,模型显示,在这个验证队列中较小儿童子集(n = 31,6 岁或以下)的 AUC 范围为 0.61 至 0.89,其中使用 31 个标记的集成模型再次获得了最高准确度。研究者还测试了该组是否可以用于预测另一个较年轻队列(116 名患有 ASD 的儿童和 60 名被认为是神经正常的儿童,年龄在 1-8 岁之间,29.5% 为女性)中患 ASD 的风险。训练后的模型的 AUC 为 0.89,男性和女性的表现相对均衡。当将年龄范围缩小到 6 岁或以下和 4 岁或以下时,该模型的 AUC 均为 0.91。按年龄分层测试了这 31 个标记与这个较年轻队列中的 ASD 之间的关联,并确认其中大多数关联仍然是可重现的(图4b)。总之,这些结果证明了训练模型和 31 个标记组在年龄、性别和队列中的稳健性。
为了进一步测试 31 个标记多界小组在不同人群中的可重复性,研究者整合了来自亚洲、欧洲和美洲 36-41 的六个公共数据集的 237 个粪便宏基因组数据。该小组在区分患有 ASD 的儿童和被认为是神经正常的儿童时,AUC 为 0.78,灵敏度为 65.30%,特异性为 72.4%。更重要的是,它对男性和女性表现出了可比的性能,证实了构建模型对两种性别的适用性。总体而言,这个 31 个标记多界小组可能与不同的人群和地理位置相关。
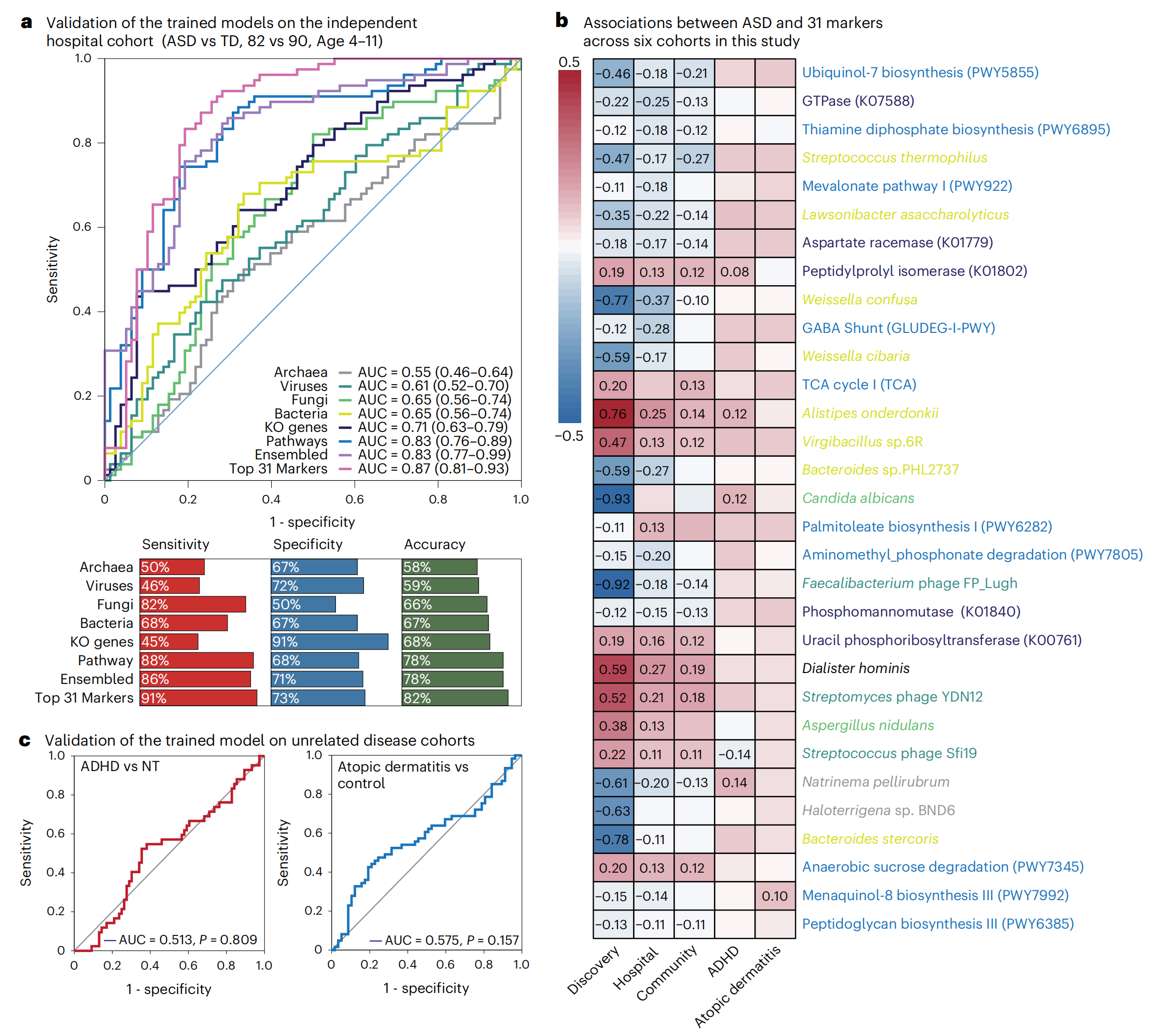
图4-随机森林模型的验证
自闭症患者泛醇-7 和硫胺素二磷酸减少
先前的研究表明,泛醇可改善自闭症儿童的症状。血浆硫胺素(维生素 B1)及其相关代谢物(如硫胺素二磷酸)浓度降低与自闭症有关。然而,这些观察结果背后的原因仍不清楚。研究发现,泛醇-7 生物合成途径和硫胺素二磷酸生物合成途径的相对丰度主要决定了诊断模型的准确性,并且与被认为是神经正常的儿童相比,三个队列中的自闭症儿童表现出一致的减少(图4b)。这两条途径共有 17 种酶参与,其中大多数在不同队列中的自闭症儿童中被耗尽。总之,这些发现强调,肠道微生物群中泛醇-7 和硫胺素二磷酸生物合成基因丰度的降低可能与自闭症密切相关。
研究总结
该研究提出了一种高度特异性的多界微生物组,用于非侵入性诊断 ASD。通过对异质性 ASD 的综合分析,开发可重复的微生物组生物标志物和准确的疾病预测模型,为未来的临床诊断测试和假设驱动的机制研究奠定基础。
参考文献:
Su Q, Wong OWH, Lu W, et al. Multikingdom and functional gut microbiota markers for autism spectrum disorder.Nat Microbiol.Published online July 8, 2024. doi:10.1038/s41564-024-01739-1
联系人:吴晨雪
手机:15602945134
电话:0755-32960208
邮箱:rosellebio@126.com
地址: 广东省深圳市盐田区壹海中心1203室