结直肠癌的发生与肠道菌群密切相关,某些细菌如拟杆菌和消化链球菌在患者肠道中富集,可能促进肿瘤生长。宏基因组测序发现,口腔链球菌(P. stomatis)在结直肠癌患者中显著富集,是重要的差异标记物。P. stomatis通常栖息于口腔,但其在结直肠癌发病机制中的具体作用仍需深入研究。
2024年7月25日,香港中文大学于君教授(香港科学院院士、欧洲科学院外籍院士)与黄子隽作为共同通讯在Cell Host & Microbe期刊在线发表题为“Peptostreptococcus stomatis promotes colonic tumorigenesis and receptor tyrosine kinase inhibitor resistance by activating ERBB2-MAPK”的研究论文。研究团队通过蛋白组+转录组,以及多种分子生物学技术及动物实验,发现了一种致癌细菌-口腔链球菌(P. stomatis),并揭示了其通过诱导细胞增殖、抑制细胞凋亡和损害肠道屏障功能来加速结肠肿瘤发生的机制。

结直肠癌是一种常见的恶性肿瘤,其发生与肠道菌群密切相关。越来越多的研究表明,肠道菌群的失调与结直肠癌的发生发展密切相关。某些特定的细菌,如拟杆菌和消化链球菌,在结直肠癌患者的肠道中富集,并可能通过多种机制促进肿瘤的生长。此外,肠道菌群还可以影响机体对癌症治疗药物的反应。研究人员通过对健康对照组和结直肠癌(CRC)患者的宏基因组测序发现,口腔链球菌(P. stomatis)在CRC患者的粪便和结肠粘膜中显著富集。进一步的跨队列宏基因组分析表明,P. stomatis是CRC患者中一个重要的差异标记物。P. stomatis是一种通常栖息于口腔的厌氧革兰氏阳性细菌,但其在CRC发病机制中的具体作用仍有待深入研究。

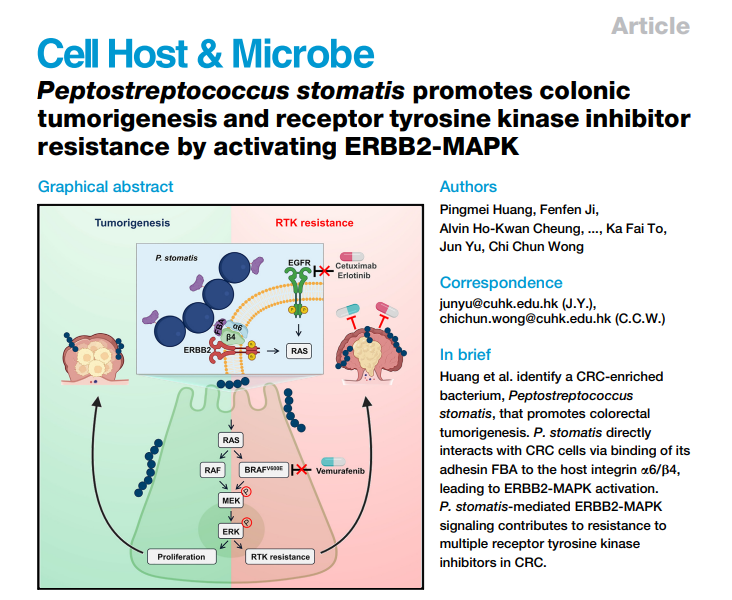
1.P. stomatis在结直肠癌患者中富集及其促肿瘤作用研究
多队列分析和组织样本分析显示,P. stomatis 在CRC患者中的丰度显著高于健康受试者,并随着疾病进展而增加。网络分析表明P. stomatis 与多种致病菌共同富集,并与益生菌E. rectale 负相关。小鼠实验进一步证明,P. stomatis 在肿瘤小鼠中定殖时间较长,并显著增加了小肠和结肠的肿瘤数量和负荷。此外,P. stomatis 处理组的小鼠表现出肠道屏障功能受损,高级别的异型增生和腺癌比例增加。这些结果表明P. stomatis 在CRC的发生和进展中可能起重要作用。
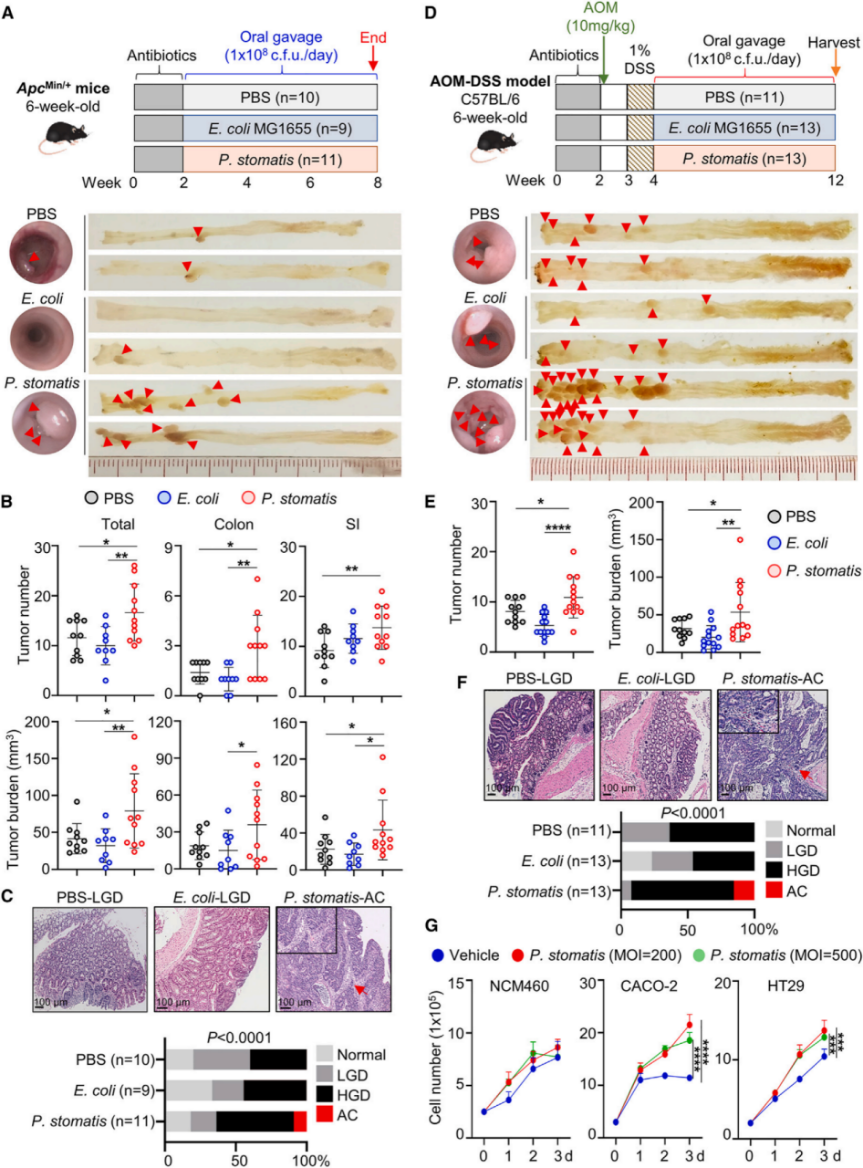
2.P. stomatis促进结直肠癌细胞增殖并抑制凋亡
通过在五种CRC细胞系和正常结肠上皮细胞系NCM460中进行共培养实验,发现P. stomatis显著增加CRC细胞的增殖而对NCM460细胞无影响,同时抑制CRC细胞的凋亡并促进G1-S细胞周期进程。此外,小鼠实验表明P. stomatis 在ApcMin/+和AOM-DSS小鼠模型中增加肿瘤细胞的增殖并抑制凋亡。实验结果显示P. stomatis 上调了细胞周期标志物Cyclin D1和CDK6的表达,并抑制了线粒体凋亡途径中的关键蛋白的切割形式。P. stomatis 对原代人CRC类器官的生长也有促进作用,进一步验证了其促癌效果。
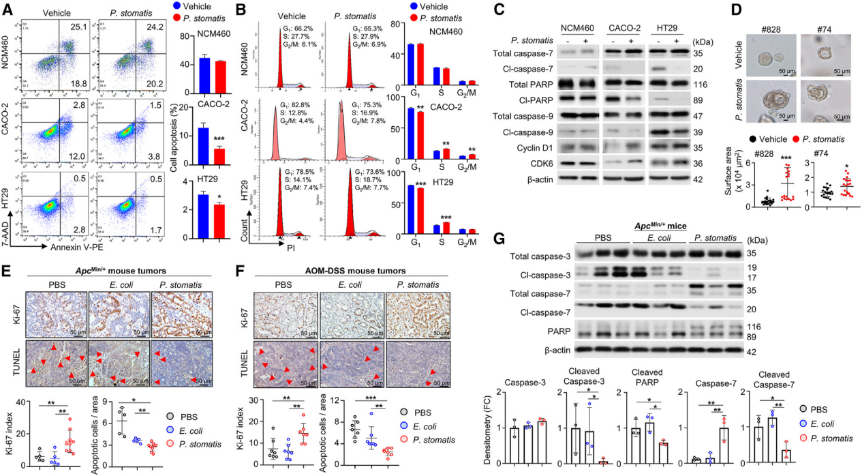
3.P. stomatis在结直肠癌细胞中的定殖及侵入机制
研究者通过荧光原位杂交(FISH)和PCR检测,发现P. stomatis 能在ApcMin/+和AOM-DSS小鼠结肠上皮细胞中定殖,并通过电镜观察(SEM和TEM)确认其在CRC细胞系(CACO-2和HT29)中的粘附和侵入能力显著高于正常结肠上皮细胞系NCM460。远西方(far-western)和生物素拉下(biotin pull-down)实验鉴定了P. stomatis表面粘附素与CRC细胞膜蛋白的相互作用,并通过质谱分析确认了特定的粘附素候选蛋白FBA(E0E2E9),该蛋白定位于细菌表面。
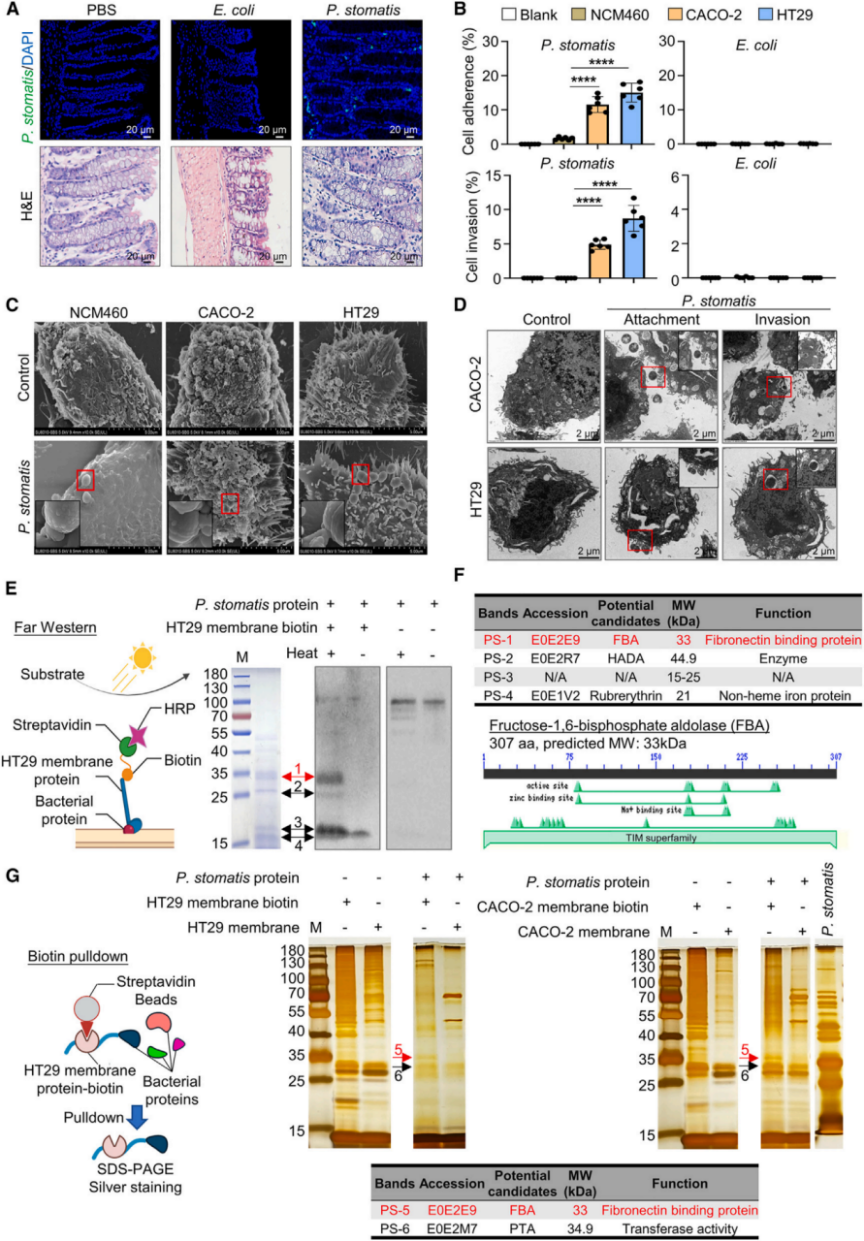
4.P. stomatis 表面蛋白FBA与CRC细胞整合素a6/b4结合的机制
通过GST拉下实验、免疫共沉淀(Co-IP)实验和微量热泳动(MST)方法,研究团队验证了FBA与CRC细胞整合素a6/b4的相互作用,测得其结合常数为1.61 μM。敲低和阻断实验表明,整合素a6/b4的敲低或阻断显著抑制了P. stomatis 在CRC细胞中的附着和侵入,并消除了P. stomatis 对CRC细胞增殖的促进作用。研究结果表明,整合素a6/b4是P. stomatis FBA的功能靶点,而非纤维连接蛋白,且整合素a6/b4在CRC细胞中的高表达可能促进了P. stomatis 的附着和侵入。
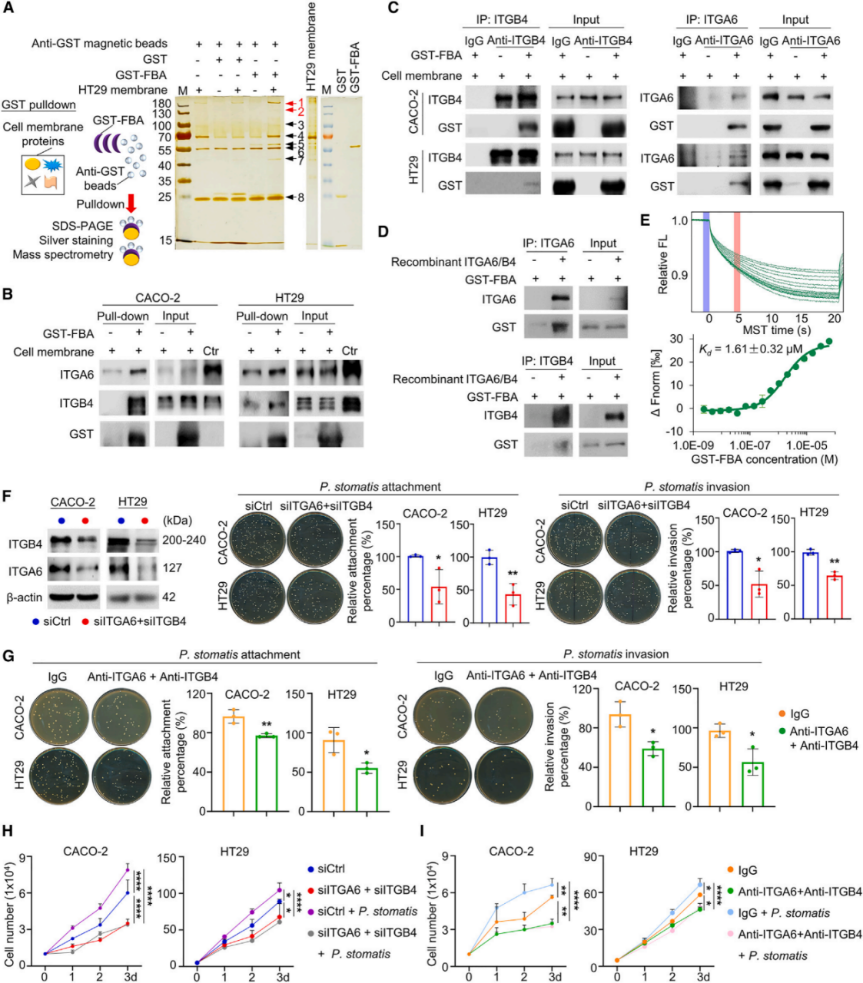
5.P. stomatis 通过FBA结合整合素a6/b4诱导CRC细胞中ERBB2及下游MAPK信号通路的机制
通过RNA测序分析,研究者发现P. stomatis 处理后的ApcMin/+小鼠肿瘤中有显著的基因表达变化,其中Ras信号通路的基因显著上调。蛋白表达分析显示,P. stomatis在CACO-2和HT29细胞中增加了整合素a6/b4和p-ERBB2的表达,激活了Ras-MAPK信号通路,包括c-RAF、MEK、ERK和p90RSK的磷酸化。在ApcMin/+小鼠模型中,P. stomatis 处理同样导致整合素a6/b4-ERBB2-MAPK通路的激活,增加了p-ERK的表达。
小鼠实验和免疫组化分析进一步确认了P. stomatis 对ERBB2及下游MAPK信号通路的激活作用,显示了P. stomatis 处理的ApcMin/+小鼠和AOM-DSS模型中p-ERK的高表达。然而,P. stomatis未能在正常结肠上皮细胞NCM460中激活该通路,表明其作用具有癌症特异性。通过siRNA敲低和中和抗体阻断实验,进一步验证了整合素a6/b4和ERBB2在P. stomatis 诱导的信号通路激活中的关键作用。敲低或阻断整合素a6/b4和ERBB2显著抑制了P. stomatis 诱导的Ras-MAPK信号级联反应,表明整合素a6/b4-ERBB2-MAPK通路在P. stomatis 促进CRC细胞增殖中的重要作用。综上,本研究揭示了P. stomatis通过其表面蛋白FBA结合CRC细胞整合素a6/b4,并激活ERBB2及其下游MAPK信号通路,促进了CRC细胞的增殖和生存。

6.P. stomatis 通过FBA结合ERBB2-MAPK信号通路促进CRC发展及驱动RTK抑制剂耐药性
研究者通过FBA过表达实验,发现FBA过表达的E. coli促进了CRC细胞的粘附、侵入和增殖,并在AOM/DSS小鼠模型中加速了肿瘤的发生,增加了ERBB2及其下游MAPK信号分子的磷酸化水平。纯化的重组FBA直接诱导了CRC细胞增殖和ERBB2-MAPK信号级联。RTK抑制剂耐药性实验显示,P. stomatis共培养降低了西妥昔单抗和威罗菲尼对CRC细胞的抑制效果,并在原代人CRC类器官和异种移植模型中促进了这些药物的耐药性。进一步分析显示,P. stomatis 共培养增加了p-ERBB2及其下游MAPK信号分子的表达,且在RTK抑制剂治疗的CRC患者中,P. stomatis 阳性患者显示出较差的生存率趋势。研究结果揭示了P. stomatis通过FBA结合ERBB2-MAPK信号通路促进CRC发展及驱动RTK抑制剂耐药性的机制,为CRC的治疗提供了新的视角和潜在靶点。
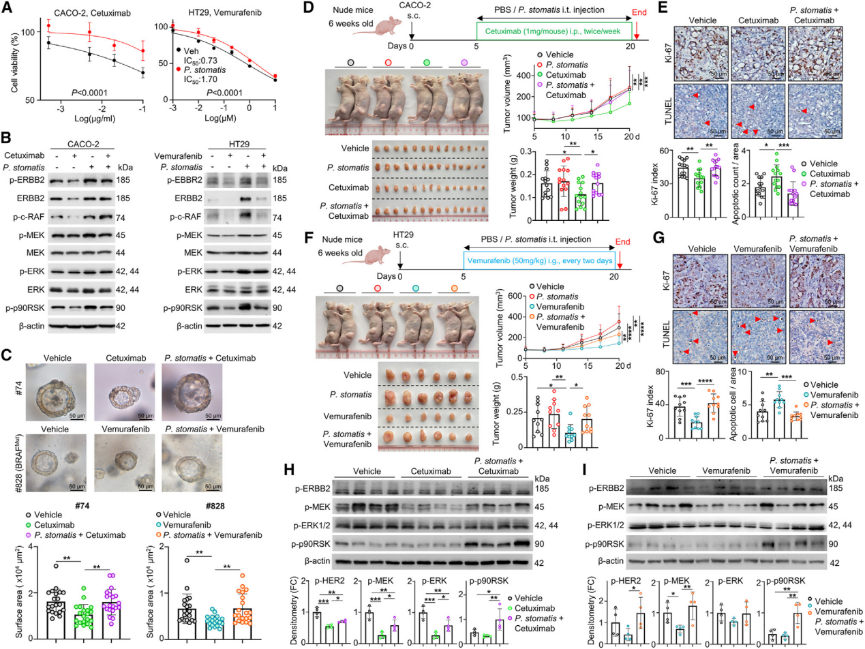

综上所述,本研究发现口腔病原菌P. stomatis通过FBA蛋白与整联蛋白α6/β4的相互作用,促进了结直肠癌(CRC)的发生。这种相互作用有助于P. stomatis在CRC肿瘤中定植,并激活ERBB2-MAPK致癌信号通路。研究还表明,P. stomatis通过一种由替代性ERBB2激活驱动的旁路机制,促进了CRC对RTK抑制剂的耐药性。因此,P. stomatis是CRC中一个重要的致癌病原体,也是潜在的治疗靶点。
牙泰中草药体内消毒防疫修复制剂助力守护世界平安。
联系人:吴晨雪
手机:15602945134
电话:0755-32960208
邮箱:rosellebio@126.com
地址: 广东省深圳市盐田区壹海中心1203室