线粒体是细胞内重要的能量代谢中心,其功能的紊乱与多种神经系统疾病的发病机制密切相关。近年来,关于线粒体代谢在神经系统疾病中的研究逐渐深入,揭示了线粒体的功能失调如何影响神经元的存活、功能以及整个神经网络的健康。以下是线粒体代谢在几种主要神经系统疾病中的最新研究进展。
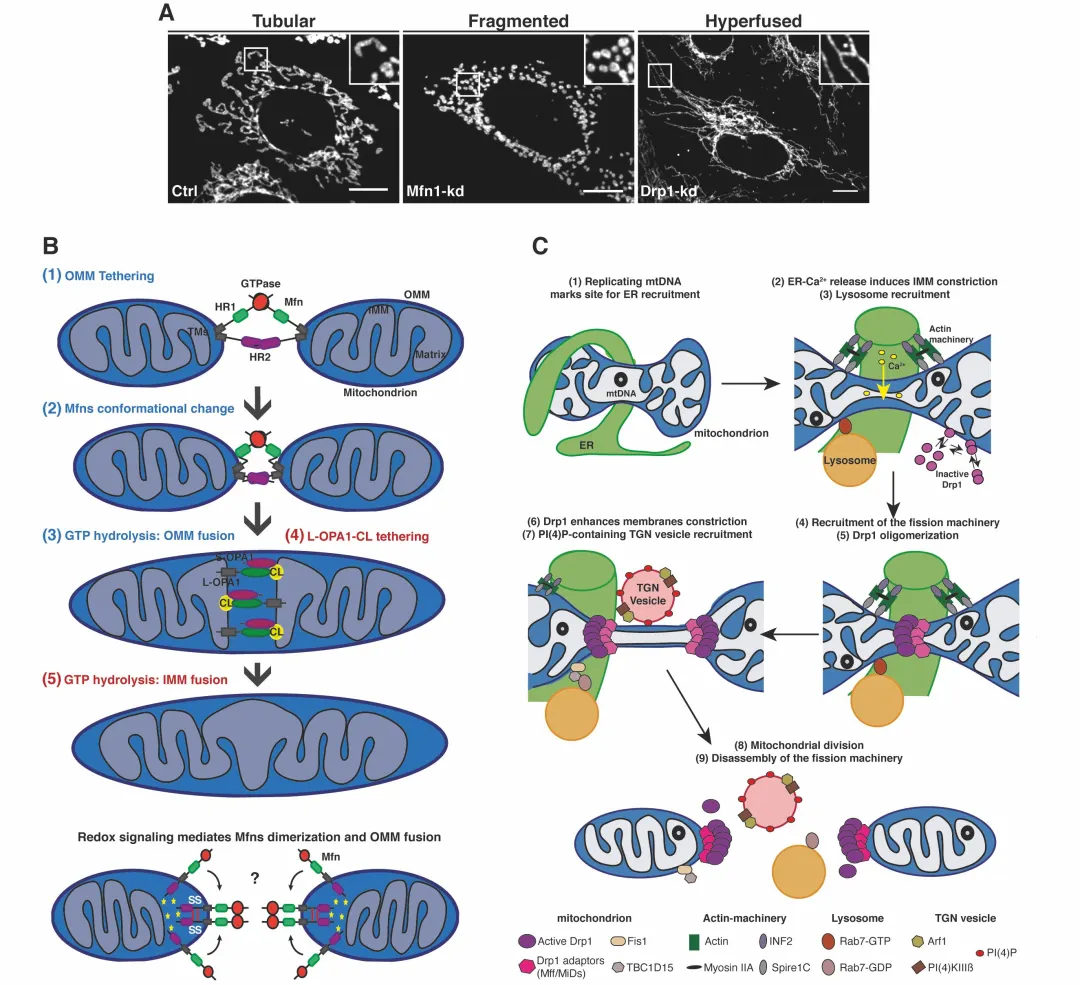
阿尔茨海默病是一种常见的神经退行性疾病,其特征为认知功能逐渐下降和神经元丧失。研究发现,线粒体功能障碍是AD的重要病理特征之一。
近年来的研究认为线粒体自噬(mitophagy)在AD中发挥重要作用。线粒体自噬通过去除损伤的线粒体来维持细胞内线粒体的健康状态(Pickrell & Youle, 2015)。相应地,线粒体自噬的功能障碍被认为与AD相关的神经退行性改变密切相关。
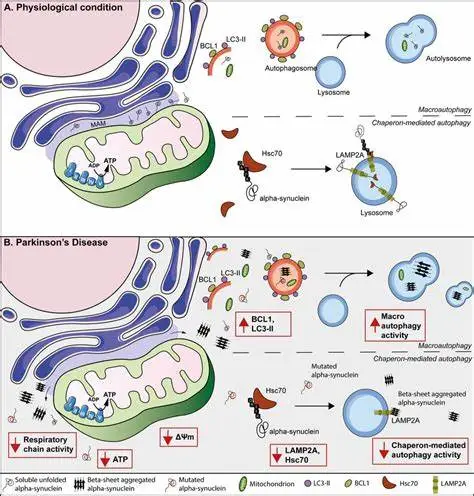
帕金森病是一种以幼年期运动障碍为主要症状的神经系统疾病,主要表现为震颤、僵硬和运动迟缓。研究表明,线粒体代谢障碍与PD的发生密切相关。
PD患者的脑部发生慢性炎症反应,而近年的研究发现线粒体释放的分子能够激活微胶质细胞,进一步加重神经炎症(Dzamko et al., 2015)。这表明修复线粒体功能可能是减轻PD炎症反应的新策略。
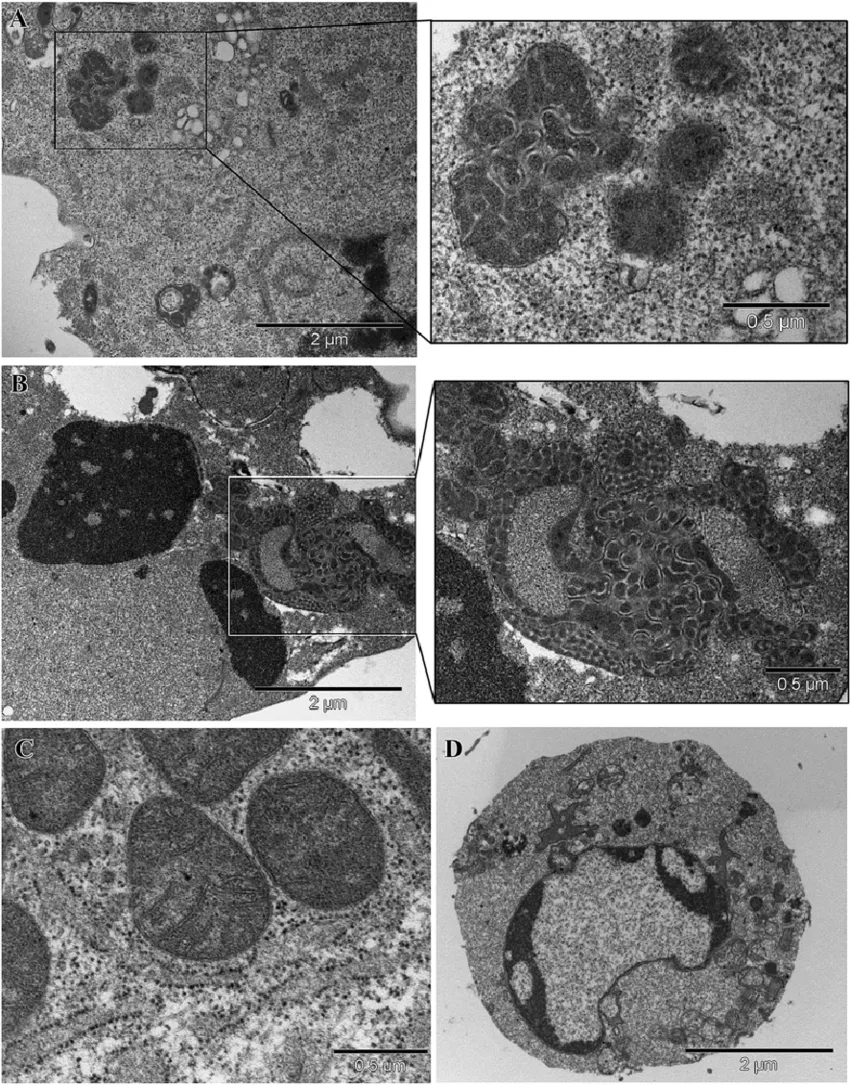
亨廷顿舞蹈病是一种遗传性神经退行性疾病,其病理特征是特定神经元(尤其是纹状体神经元)的死亡,导致运动、情感和认知功能的障碍。
最新研究还揭示了在HD中,线粒体相关的信号通路能够调节神经炎症反应,从而影响病程进展(Olivieri et al., 2020)。这为我们理解亨廷顿舞蹈病的发病机制提供了新的视角。
多发性硬化症是一种自身免疫性疾病,其特征是中枢神经系统的慢性炎症和脱髓鞘损伤。线粒体代谢在该疾病中的角色同样受到重视。
线粒体代谢在多种神经系统疾病中的异常与疾病的发病机制密切相关。随着对线粒体功能的深入研究,未来可能开发出基于线粒体的干预策略,以改善这些神经系统疾病的病程。通过修复线粒体功能、改善细胞能量代谢,可能会对神经系统疾病的治疗产生积极的影响。
1.Berridge, M. J., et al. (2014). Calcium signaling in neurons: the good, the bad, and the ugly. Nature Reviews Neuroscience, 15(5), 387-407.
2.Butterfield, D. A., & Boyd-Kimball, D. (2005). The critical role of methionine 35 in the oxidative stress and neurotoxicity of the Alzheimer amyloid β-peptide. Free Radical Biology and Medicine, 38(12), 1565-1574.
3.Dahl, J., et al. (2018). Reactive oxygen species production in multiple sclerosis: a new biomechanism linking inflammation and demyelination. Journal of Neuroinflammation, 15(1), 1-18.
4.Dzamko, N., et al. (2015). Inhibition of the mitochondrial protein PINK1 protects against inflammation-induced neurodegeneration. Neuroscience Letters, 588, 120-125.
5.Kuhl, I., et al. (2006). The Huntington's disease protein induces mitochondrial dysfunction causing neuronal cell death in a model of the disease. Neuroscience, 140(1), 239-251.
6.Mayerhofer, T. et al. (2022). Targeting mitochondrial metabolism in multiple sclerosis. Journal of Cellular and Molecular Medicine, 26(1), 165-174.
7.Möller, H. E., et al. (2019). Mitochondrial dysfunction and oxidative stress in multiple sclerosis. Molecular Neurobiology, 56(4), 2141-2157.
8.Outeiro, T. F., & Lindquist, S. (2003). Yeast cells provide insights into α-synuclein biology and pathology. Nature Reviews Molecular Cell Biology, 4(5), 410-417.
9.Pickrell, A. M., & Youle, R. J. (2015). The roles of PINK1, parkin, and mitochondrial fidelity in human disease. Cell, 162(3), 531-540.
10.Schapira, A. H. (2008). Mitochondrial disease and neurodegeneration. Nature, 454(7200), 150-157.
11.Shey, M., et al. (2021). Mitochondrial dysfunction and amyloid pathology in Alzheimer’s disease. Cell Metabolism, 33(3), 497-506.
12.Swerdlow, R. H., et al. (2014). Mitochondria and the pathogenesis of Alzheimer’s disease. Journal of Alzheimer’s Disease, 40(3), 557-563.
13.Valente, E. M., et al. (2004). Mutations in PINK1 are associated with sporadic early-onset parkinsonism. Nature, 427(6975), 453-456.
Olivieri, F., et al. (2020). Mitochondrial function and neuroinflammation in Huntington's disease: recent advances in understanding.Neurological Sciences, 41(8), 2161-2168.
联系人:吴晨雪
手机:15602945134
电话:0755-32960208
邮箱:rosellebio@126.com
地址: 广东省深圳市盐田区壹海中心1203室