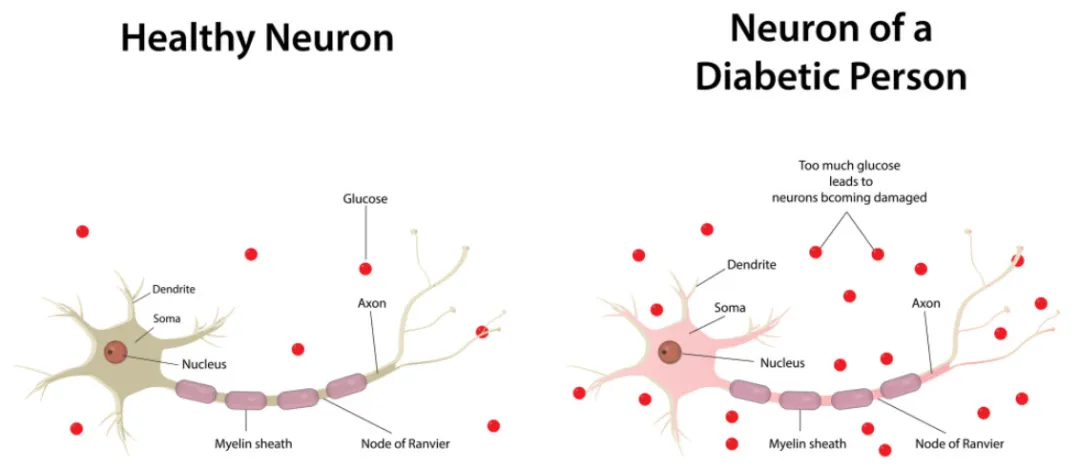
糖尿病周围神经病变(Diabetic peripheral neuropathy, DPN)是糖尿病最常见的慢性并发症之一,主要表现为感觉、运动和自主神经系统功能障碍。长期高血糖是导致DPN的主要病因,其具体发病机制包括以下几个方面:
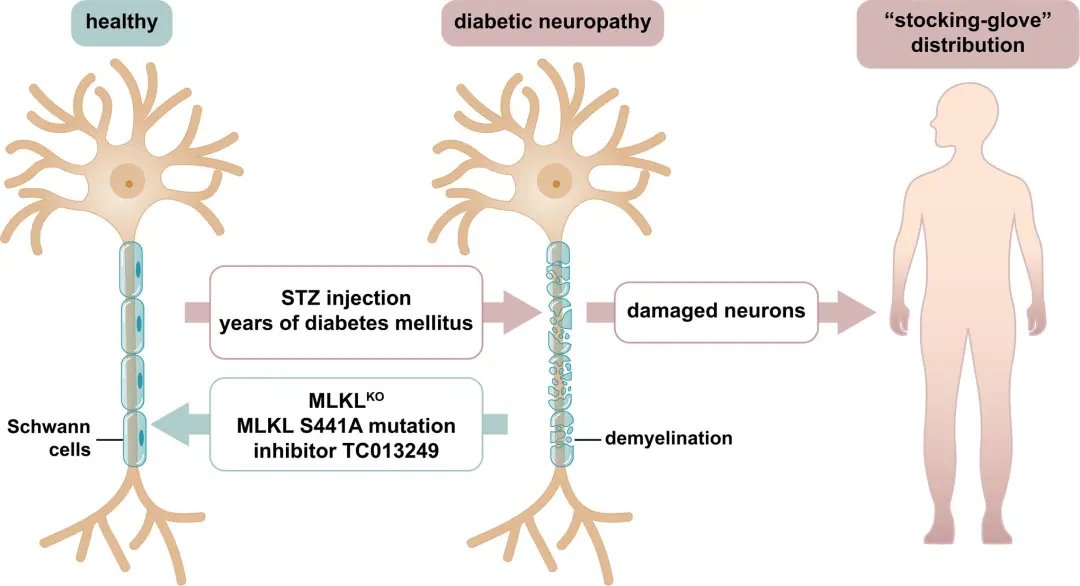
此外,高血糖还会导致免疫失衡,抑制神经修复,加重神经退行性改变。
同时,高血糖还会诱发血小板聚集和凝血功能异常,加重神经血管狭窄和血栓形成,进一步加重神经缺血状况。综上所述,长期高血糖通过激活聚醇通路、PKC通路、非酶促糖基化反应、氧化应激等多种途径,造成神经细胞代谢紊乱、能量供给障碍、神经营养缺乏、神经炎症反应增强、神经血管功能障碍等一系列病理改变,最终导致神经组织的功能障碍和结构损害,从而引发糖尿病周围神经病变的发生和发展。
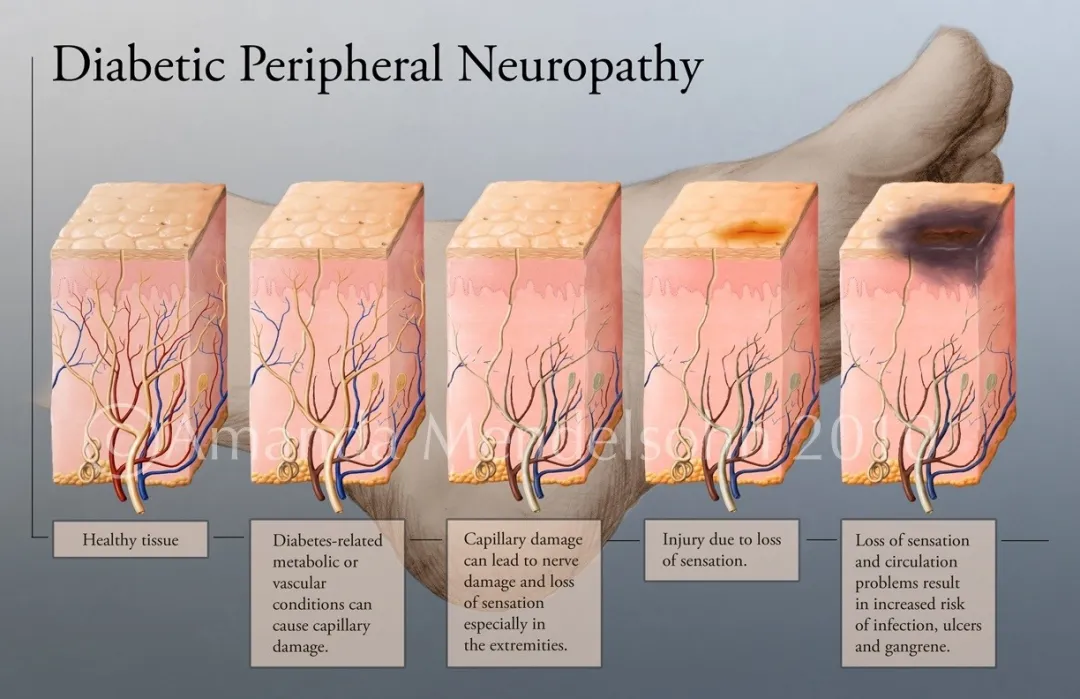
最新的研究进展
综上所述,高血糖通过激活多种代谢通路、诱发神经细胞自身机制障碍、引发炎症反应以及造成微循环障碍等方式,最终导致神经损害,从而引发糖尿病周围神经病变的发生和发展。随着对DPN发病机制的深入研究,基于表观遗传学调控、神经保护/调理、神经再生等新策略的DPN防治措施正在不断涌现,为改善DPN患者的预后带来新的希望。
参考文献:
1.Zhang Y, Chen X, Zhao Y, et al. The role of transcription factor Gata2 in the hyperglycemia-induced dysfunction of mouse peripheral nerves[J]. Biochemical and Biophysical Research Communications, 2020, 521(2): 308-314.
2.Zhu P, Xiong W, Tan Y, et al. Downregulation of miR-335-5p by lncRNA H19 promotes chondrocyte extracellular matrix degradation in osteoarthritis. Biochemical and biophysical research communications, 2018, 503(2): 612-618.
3.Xu J, Liu X, Chen J, et al. Exosomes derived from umbilical cord mesenchymal stem cells alleviate diabetic peripheral neuropathy by downregulating RAGE and relieving oxidative stress. The American journal of the medical sciences, 2019, 357(1): 65-74.
4.Sun W, Miao B, Wang XC, et al. Glycosylation of voltage-gated sodium channels leads to the development of diabetic neuropathy. The FASEB Journal, 2018, 32(1): 313-324.
5.Yamagishi SI. Potential clinical utility of advanced glycation end product cross-link breakers in age-and diabetes-associated disorders. Rejuvenation research, 2012, 15(6): 564-572.
6.Zheng L, Kern TS. Role of nitric oxide, superoxide, peroxynitrite and poly (ADP-ribose) polymerase in diabetic retinopathy. Frontiers in bioscience: a journal and virtual library, 2009, 14: 3974.
联系人:吴晨雪
手机:15602945134
电话:0755-32960208
邮箱:rosellebio@126.com
地址: 广东省深圳市盐田区壹海中心1203室