炎症因子风暴(Cytokine Storm)是指在某些疾病或创伤情况下,机体产生大量炎症性细胞因子的过度反应。这种失控的炎症反应不仅可能导致全身器官功能衰竭,也会对中枢神经系统造成严重损害。在神经损伤的病理过程中,炎症因子风暴发挥着关键作用,参与了神经细胞的损伤、凋亡以及神经功能障碍的发生。本文详细阐述炎症因子风暴在神经损伤中的作用机制。
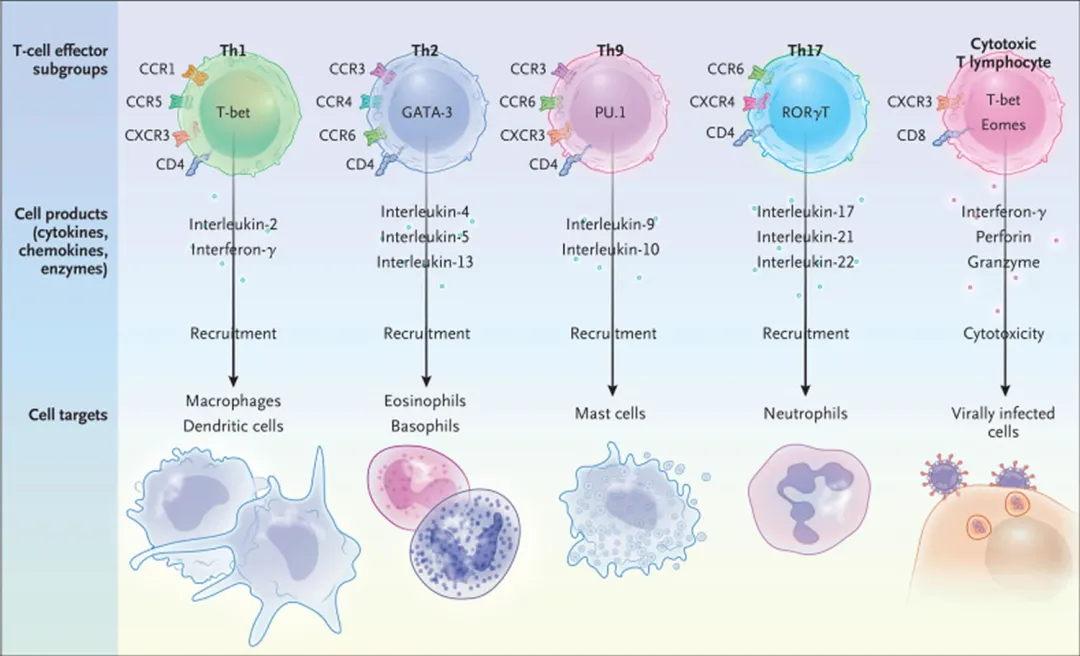
神经损伤,无论是外伤性、缺血性还是神经变性性质的,都会引发机体的炎症反应。这种炎症反应首先发生在受损部位的神经组织中,随后扩散到全身。受损的神经细胞、微小胶质细胞(Microglia)和星形胶质细胞(Astrocyte)等会释放大量的炎症性细胞因子,如肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、干扰素γ(IFN-γ)等。这些炎症因子相互激活,形成一种自我放大的正反馈循环,导致了炎症因子风暴的发生[1]。
炎症因子风暴对神经细胞造成损害的主要机制包括以下几个方面:
炎症因子如TNF-α、IL-1β等可以激活神经细胞内的氧化应激通路,导致大量活性氧(ROS)和活性氮(RNS)的产生。这些活性物种会损害神经细胞的DNA、蛋白质和脂质,引发细胞凋亡。同时,炎症因子还可以直接激活神经细胞内的凋亡信号通路,如Fas/FasL通路和线粒体凋亡通路,进一步加剧神经细胞的死亡[2]。
一些炎症因子,如TNF-α和IL-1β,可以增强神经细胞对兴奋性氨基酸(如谷氨酸)的敏感性,导致神经细胞过度兴奋,引发兴奋性毒性。这种兴奋性毒性会造成神经细胞内钙离子浓度升高,激活一系列细胞损伤信号通路,最终导致神经细胞的死亡[3]。
炎症因子可以增加血脑屏障的通透性,使外周炎症因子进入中枢神经系统,加剧神经组织的炎症反应。同时,血脑屏障的破坏也会导致神经营养因子、抗氧化酶等保护性物质流失,进一步加重神经细胞的损害[4]。
炎症因子还可以干扰神经突触的正常功能。例如,TNF-α可以促进突触前神经递质的释放,而抑制突触后神经递体的重吸收,导致突触功能失调。IL-1β则可以抑制长时程增强(LTP)等突触可塑性过程,影响神经元的信息传递[5]。
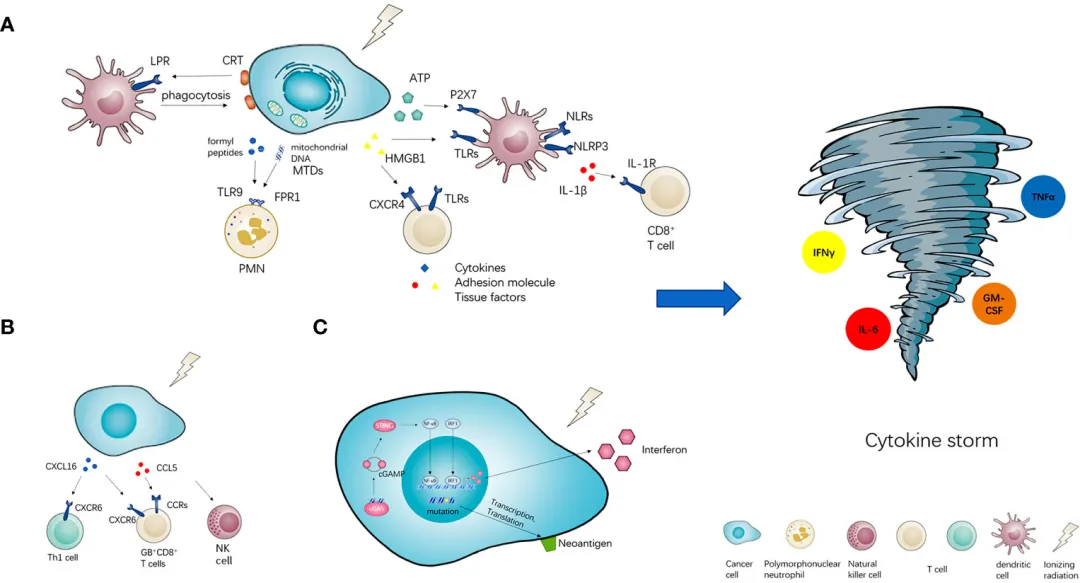
炎症因子风暴不仅直接损害神经细胞,还会通过多种机制影响神经功能:
炎症因子可以改变神经元的膜电位和离子通道功能,降低神经元的兴奋性和传导速度,导致神经功能障碍。例如,TNF-α可以抑制钾离子通道的活性,而IL-1β则可以降低钠离子通道的表达[6]。
如前所述,炎症因子可以干扰神经突触的正常功能,抑制LTP等突触可塑性过程,影响神经元间的信息传递和整合,从而损害学习记忆等高级神经功能[5]。
炎症因子风暴不仅直接损害神经细胞,还可以抑制神经再生和修复的相关过程。例如,TNF-α和IL-1β可以抑制轴突再生,而IFN-γ则可以抑制神经干细胞的增殖和分化[7]。
持续的炎症因子风暴还可能导致神经性疾病的发生。例如,在阿尔茨海默病、帕金森病等神经变性疾病中,炎症因子风暴参与了神经元的持续损害和功能障碍[8]。
鉴于炎症因子风暴在神经损伤中的关键作用,调控炎症反应成为神经保护和功能修复的重要治疗靶点。主要的治疗策略包括:
1.抑制炎症因子的产生和释放:通过使用抗炎药物、抗氧化剂等,抑制TNF-α、IL-1β、IL-6等炎症因子的产生和释放。
2.阻断炎症信号通路:靶向NF-κB、MAPK等炎症信号通路,抑制炎症因子风暴的放大和持续。
3.增强神经保护机制:促进神经营养因子的表达,激活Nrf2等抗氧化通路,增强神经细胞的抗炎和抗氧化能力。
4.调节免疫细胞功能:调控微小胶质细胞和星形胶质细胞的活化状态,促进其向保护性表型转化,减轻神经炎症反应。
5.干预血脑屏障通透性:维护血脑屏障的完整性,阻止外周炎症因子进入中枢神经系统。
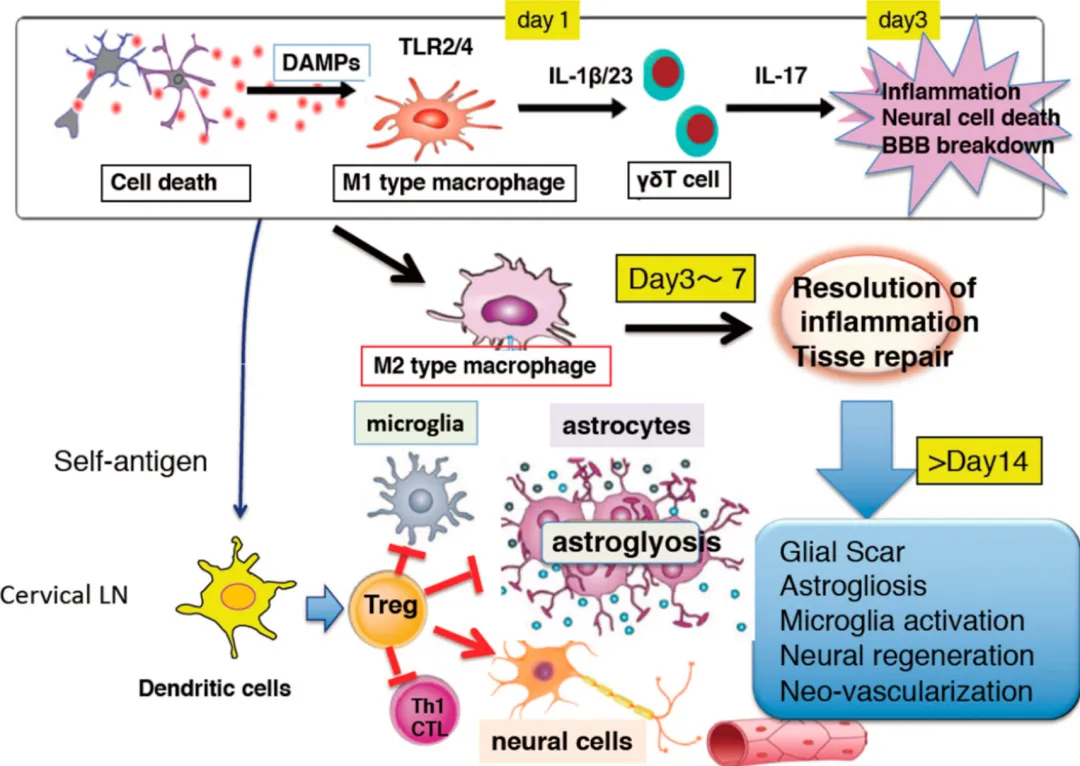
综上所述,炎症因子风暴在神经损伤的发生发展中发挥着关键作用,通过多种机制导致神经细胞损害和神经功能障碍。因此,调控炎症因子风暴成为神经保护和功能修复的重要治疗策略。深入理解炎症因子风暴在神经损伤中的作用机制,有助于开发针对性的治疗方法,为神经系统疾病的治疗提供新的思路。
参考文献
1.Iadecola, C., & Anrather, J. (2011). The immunology of stroke: from mechanisms to translation. Nature medicine, 17(7), 796-808.
2.Beattie, E. C., Stellwagen, D., Morishita, W., Bresnahan, J. C., Ha, B. K., Von Zastrow, M., ... & Malenka, R. C. (2002). Control of synaptic strength by glial TNFα. Science, 295(5563), 2282-2285.
3.Viviani, B., Bartesaghi, S., Gardoni, F., Vezzani, A., Behrens, M. M., Bartfai, T., ... & Marinovich, M. (2003). Interleukin-1β enhances NMDA receptor-mediated intracellular calcium increase through activation of the Src family of kinases. The Journal of neuroscience, 23(25), 8692-8700.
4.Obermeier, B., Daneman, R., & Ransohoff, R. M. (2013). Development, maintenance and disruption of the blood-brain barrier. Nature medicine, 19(12), 1584-1596.
5.Prieto, G. A., & Cotman, C. W. (2017). Cytokines and cytokine networks target neurons to modulate long-term potentiation. Cytokine & growth factor reviews, 34, 27-33.
6.Rossi, D. (2015). Astrocyte physiopathology: at the crossroads of intercellular networking, inflammation and cell death. Progress in neurobiology, 130, 86-120.
7.Hellenbrand, D. J., Reichl, K. A., Travis, B. J., Filipp, F. V., & Bohnert, K. A. (2019). Targeting the inflammatory cytokine interferon-gamma to promote central nervous system regeneration. Frontiers in cellular neuroscience, 13, 494.
8.Heneka, M. T., Kummer, M. P., & Latz, E. (2014). Innate immune activation in neurodegenerative disease. Nature reviews Immunology, 14(7), 463-477.
联系人:吴晨雪
手机:15602945134
电话:0755-32960208
邮箱:rosellebio@126.com
地址: 广东省深圳市盐田区壹海中心1203室